L'hydrogène (Z = 1)
Bien que ce soit l'élément chimique le plus léger (son noyau contient un seul proton, autour duquel tourne un unique électron), c'est également le plus abondant, puisqu'il s'agit du principal constituant des nébuleuses et des étoiles : dans l'univers, près de 92 % des atomes sont des atomes d'hydrogène (ce qui représente 74 % de la masse totale) !

Crédit : Two Micron All Sky Survey
Sur Terre, on le trouve principalement dans la molécule d'eau (H2O), mais il y en a également dans les hydrocarburesLes hydrocrabures sont des composés organiques constitués uniquement d'atomes de carbone et d'hydrogène. (méthane, butane...), ainsi que dans une multitude de composés organiques. Lorsqu'il est à l'état gazeux, il se présente sous la forme de molécules de dihydrogène ayant pour formule H2. Toutefois, on peut également le trouver sous forme monoatomique (H), notamment dans le gaz interstellaire et intergalactique, là où règnent des conditions de pression et de température extrêmement basses.
Origine de l'hydrogène
Selon les théories actuelles, il y a près de 13,7 milliards d'années, eut lieu un événement cataclysmique auquel on donne le nom de Big Bang. Pour ce que l'on en sait, pendant les 380 000 premières années (à quelques jours près) consécutives à cet événement, la matière se présentait alors essentiellement sous la forme d'un plasma (gaz ionisé) extrêmement chaud, constitué d'un mélange de noyaux d'atomes d'hydrogène (protons) et d'hélium (particules alpha), ainsi que d'électrons. Toutefois, l'Univers étant en expansion rapide, cela entraîna une baisse rapide de la densité de matière et de la température. Lorsque cette dernière descendit en dessous de 3000 kelvins, les électrons, moins agités, s'associèrent aux noyaux pour donner les tout premiers atomes stables d'hydrogène et d'hélium (ainsi qu'un peu de lithium). Les autres atomes, plus complexes, n'apparurent que quelques centaines de millions d'années plus tard, au coeur des premières étoiles. Celles-ci sont en effet de véritables réacteurs nucléaires, qui passent la majeure partie de leur existence à réaliser la fusion de l'hydrogène en hélium (elles appartiennent alors à la séquence principale), avant de passer à la fusion de l'hélium en carbone et en oxygène... C'est ainsi que lentement (très lentement), mais sûrement, l'univers s'appauvrit en hydrogène et s'enrichit en éléments plus lourds.
Un peu d'histoire
En 1766, le savant britanique
Henry Cavendish (1731-1810) reprend une expérience réalisée au XVIè siècle par le médecin suisse Paracelse
(1493-1541). Ce dernier avait constaté qu'en faisant agir de l'acide sulfurique sur du fer, il obtenait un
gaz inflammable de nature inconnue. En faisant agir des acides sur différents métaux, Cavendish
parvient à isoler ce gaz combustible, qu'il appelle "air inflammable". En 1783, celui-ci est rebaptisé
hydrogène par le chimiste français Antoine Laurent de Lavoisier (1743-1794). Ce nom, forgé
à partir des racines grecques "hudôr" (eau) et "gennen" (engendrer), signifie donc "qui
engendre l'eau" : en effet, si l'on brûle de l'hydrogène dans de l'oxygène, on obtient... de l'eau
!.
(1731-1810) reprend une expérience réalisée au XVIè siècle par le médecin suisse Paracelse
(1493-1541). Ce dernier avait constaté qu'en faisant agir de l'acide sulfurique sur du fer, il obtenait un
gaz inflammable de nature inconnue. En faisant agir des acides sur différents métaux, Cavendish
parvient à isoler ce gaz combustible, qu'il appelle "air inflammable". En 1783, celui-ci est rebaptisé
hydrogène par le chimiste français Antoine Laurent de Lavoisier (1743-1794). Ce nom, forgé
à partir des racines grecques "hudôr" (eau) et "gennen" (engendrer), signifie donc "qui
engendre l'eau" : en effet, si l'on brûle de l'hydrogène dans de l'oxygène, on obtient... de l'eau
!.
Comme il s'agit du gaz le plus léger (il est 14 fois moins dense que l'air), le dihydrogène a très vite été employé pour gonfler des ballons : le 27 août 1783, celui conçu par le physicien Jacques Charles (1746-1823) s'élève dans les airs, dans l'est du Val d'Oise. Quelques mois plus tard, le 1er décembre 1783, un autre ballon à hydrogène (ou "charlière") décolle depuis les Tuileries, emportant à son bord ce même Jacques Charles accompagné de l'ingénieur Nicolas-Louis Robert.

accompli le 1er décembre 1783.
Dessin d'Antoine Louis François Sergent
Quelques décennies plus tard, les premiers dirigeables (gros ballons propulsés par des hélices), seront eux aussi gonflés à l'hydrogène, ce qui n'ira pas sans poser quelques problèmes car, en plus d'être un excellent combustible (et donc potentiellement explosif), ce gaz est particulièrement sujet aux fuites (il diffuse très facilement à travers les parois poreuses). C'est ainsi que le 6 mai 1937, un gros dirigeable allemand de type zeppelin, l'Hindenburg, long de 245 mètres et contenant près de 200 000 m3 de dihydrogène, en fera l'amère expérience. Alors qu'il arrive à Lakehurst (dans le New Jersey, au sud de l'état de New York) après avoir effectué sa trente-septième traversée de l'Atlantique, il s'enflamme subitement !, entraînant la mort de 35 passagers (sur un total de 94) qui se jetterons dans le vide afin d'échapper aux flammes. Le plus navrant dans tout cela, c'est que l'Hindenburg aurait dû être gonflé à l'hélium, gaz non inflammable, mais les Etats-Unis, principaux producteurs de ce gaz (c'était vrai à l'époque, ça l'est encore aujourd'hui), imposaient alors un embargo interdisant d'exporter de l'hélium vers l'Allemagne nazie, qui n'eut d'autre alternative que l'emploi de dihydrogène pour gonfler ses dirigeables.

Crédit : Murray Becker
Outre le ballon de Jacques Charles, l'hydrogène va rapidement trouver d'autres applications. En 1804, l'artilleur (et homme politique) suisse Isaac de Rivaz met au point ce qui est sans doute le tout premier moteur à combustion interne, et cela un demi-siècle avant que Beau de Rochas n'imagine le principe du moteur à quatre temps. S'inspirant du "pistolet de Volta", dans lequel l'explosion d'un mélange gazeux est déclanchée par une étincelle, le moteur de Rivaz est alimenté par un mélange de sulfure d'hydrogène et d'oxygène, dont l'explosion met en mouvement un piston dans un cylindre. En 1806, il adapte son moteur à un petit véhicule de démonstration, la "charrette de Rivaz".

alimenté par de l'hydrogène gazeux
En 1784, l'inventeur Jan Pieter Minckelers découvre le gaz d'éclairage, qu'il obtient en distillant de la houille. Constitué principalement d'un mélange de monoxyde de carbone et de dihydrogène, il en sera fait usage à grande échelle dès le début du XIXè siècle, sous l'impulsion du français Philippe Lebon et de l'anglais William Murdoch. Fabriqué dans des usines présentant un aspect complexe, les fameuses "usines à gaz" (l'expression vient de là), il concourera à l'éclairage nocturne des grandes villes européennes, contribuant à améliorer de façon notable la sécurité des citoyens.

par George Rowlandson (1809).
Propriétés de l'hydrogène
Le dihydrogène est le gaz le plus léger : 0,09 g/L dans les
CNTPLes CNTP ou conditions normales de température et de pression sont
considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire,
définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013
bars)..
Même lorsqu'il passe à l'état liquide (à -253°C, sous une pression de 1 bar), sa masse volumique reste très
faible : 71 kg/m3.
L'hydrogène est un véritable concentré d'énergie puisqu'à masse égale, sa combustion libère trois fois plus
d'énergie que l'essence. Malheureusement, même sous forme liquide , sa faible masse volumique fait qu'il occupe un
volume important : à quantité d'énergie libérée égale, il prend quatre fois plus de place que le pétrole.
Dans les solutions aqueuses, l'hydrogène peut donner des ions H+, responsables de leur
caractère acide. Le pH, nombre qui caractérise l'état acide ou basique d'une solution, est en effet
directement lié à la concentration en ions hydrogène : plus le pH d'une solution est faible, plus cette dernière
est acide et plus elle contient d'ions H+.
Les solutions acides sont omniprésentes dans la nature. Ainsi, la plupart des fruits donnent des jus acides.
Notre estomac lui-même contient de l'acide chlorhydrique, responsable des brûlures d'estomac et autres
remontées acides consécutives aux repas trop gras et aux excès d'alcool. L'acide chlorhydrique est en
effet l'un des principaux constituants des sucs gastriques, découverte faite en 1823 par un certain
William Prout (cela ne s'invente pas !), chimiste et médecin anglais auquel on doit également la
classification des aliments en lipides, glucides et protéines.
Plus surprenant, il existe sur Terre des lacs acides, l'un des plus connus (et des plus acides) étant
le lac qui s'est formé dans le cratère du volcan Kawah Ijen (dont le nom signifie "cratère vert"),
situé sur l'île de Java, en Indonésie
!.
Le pH de son eau étant proche de zéro, cette dernière est donc nettement plus acide que du vinaigre
ou du jus de citron (dont le pH est proche de 2,4) !

Production industrielle de l'hydrogène
Annuellement, ce sont près de 75 millions de tonnes d'hydrogène qui sont produites au niveau mondial, principalement à partir de gaz naturel et de pétrole. Seule une petite partie de cette production provient de l'électrolyse de l'eau, le procédé étant nettement plus coûteux. Plusieurs méthodes sont employées, que nous allons décrire succintement.
- Le vaporeformage consiste à décomposer des molécules d'hydrocarbures légers (généralement du méthane), sous l'action de la vapeur d'eau à haute température (environ 900°C), sous une pression de 20 à 30 bars, en présence de nickel (qui joue le rôle de catalyseur). Avec le méthane, la réaction est la suivante :
CH4 + H2O ---> 4 H2 + CO2
Cette méthode assure à elle seule 48% de la production totale d'hydrogène.
- L'oxydation partielle couvre environ 30% des besoins en hydrogène. Celui-ci est obtenu en faisant réagir du dioxygène avec des hydrocarbures légers, à haute température (de 1 200 à 1 500°C) et sous forte pression (entre 20 et 90 bars). Toujours avec le méthane, la réaction est la suivante :
2CH4 + O2 ---> 4 H2 + 2CO
- La gazéification du charbon, qui assure environ 18% de la production d'hydrogène, consiste à produire un mélange de gaz (monoxyde de carbone, dihydrogène, dioxyde de carbone et méthane) à partir de charbon, d'oxygène et de vapeur d'eau (c'est un peu long à expliquer, alors je passe mon tour).
- L'électrolyse de l'eau ne couvre que 4% de nos besoins. Réalisée pour la première fois le 2 mai 1800 par les chimistes britanniques William Nicholson et Sir Anthony Carlisle, cette technique consiste à décomposer l'eau en dioxygène et dihydrogène gazeux grâce à un courant électrique. Bien que beaucoup plus coûteuse à mettre en oeuvre, elle présente toutefois l'avantage de ne pas émettre de CO2, à condition toutefois d'utiliser une électricité décarbonée (donc d'origine renouvelable ou nucléaire) : l'hydrogène ainsi produit est appelé hydrogène vert.
Quelques exemples d'utilisation de l'hydrogène
- La majeure partie de l'hydrogène produit sert à la synthèse de l'ammoniac (NH3), selon un procédé mis au point en 1909 par le chimiste allemand Fritz Haber. L'ammoniac s'avère en effet indispensable à la fabrication des engrais azotés (et de certains explosifs).
- L'hydrogène gazeux intervient dans le rafinage du pétrole dont il permet la désulfuration, afin de limiter les rejets d'oxydes de soufre, en partie responsables des pluies acides.

Crédit : U.S. Air Force
- L'hydrogène intervient également dans la production du méthanol (CH3-OH), alcool employé dans la synthèse de certaines matières plastiques, de résines synthétiques, de peintures, d'explosifs... Impropre à la consommation (il est hautement toxique), le méthanol est également utilisé comme antigel et comme carburant pour véhicules dans certains pays (Chine, Brésil).
- Favorisant la solidification des huiles végétales, l'hydrogène intervient dans l'élaboration des margarines.
- La pile à hydrogène (ou pile à combustible), dont le principe a été découvert en 1839 par le chimiste allemand Christian Schönbein (1799-1868), permet de produire de l'électricité grâce à l'oxydation de molécules de dihydrogène. Au niveau de l'anode, ces dernières sont décomposées en ions H+ (avec libération d'électrons), qui migrent ensuite vers la cathode (via un électrolyte) où ils se recombinent avec des ions oxygène (O2-), ce qui donne des molécules d'eau. L'électricité produite par la pile à hydrogène peut être utilisée pour alimenter des véhicules électriques (voitures, bus), des chariots élévateurs...

Le principal inconvénient de la pile à combustible est son coût, qui reste très élevé. En revanche, elle présente de nombreux atouts : elle ne dégage que de l'eau, offre un rendement supérieur à celui des moteurs thermiques, et s'avère silencieuse. Qui plus est, en cas d'inflammation du réservoir d'hydrogène, les conséquences sont moindres qu'avec un réservoir d'essence car la flamme d'hydrogène rayonne surtout dans l'ultraviolet (et non dans l'infrarouge comme l'essence), ce qui limite le risque de propagation de l'incendie.
- Lors de leur décollage, certains lanceurs alimentent leurs moteurs avec de l'hydrogène liquide (maintenu en dessous de - 253°C) et de l'oxygène liquide, qui sont injectés dans une chambre de combustion où ils brûlent en produisant de la vapeur d'eau à haute température (près de 3000°C), éjectée des tuyères à très grande vitesse. Les lanceurs Ariane 5 (à l'instar de la défunte navette spatiale américaine) utilisent ce type d'ergolsEn aéronautique, les ergols sont des substances chimiques (solides ou liquides) capables de fournir rapidement de grandes quantités d'énergie lors de leur combustion..

Les trois petites flammes dicrètes visibles sous ses tuyères
résultent de la combustion de l'hydrogène et de l'oxygène.
Crédit : NASA
- L'hydrogène pourrait, dans un avenir plus ou moins proche, permettre de stocker de l'énergie, et constituer ainsi une alternative aux batteries. En ce sens, il s'agit non pas d'une source, mais d'un vecteur d'énergie, dans la mesure où il faut d'abord produire le dihydrogène avant de le stocker, pour ensuite l'utiliser quand le besoin s'en fait ressentir (voir ici !).
- Le deutérium, isotopeOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. de l'hydrogène dont le noyau comporte un proton et un neutron, est employé pour fabriquer l'eau lourde, qui joue le rôle de modérateur de neutrons dans certains réacteurs nucléaires, notamment ceux de type Candu, utilisés au Canada.
- Et puisqu'il est question de nucléaire, n'oublions pas de mentionner cette monstruosité qu'est la bombe à hydrogène (ou bombe H). Nous pouvons voir sur l'image ci-dessous l'explosion de la bombe la plus puissante jamais testée par les Etats-Unis, Castle Bravo, dont la puissance a été estimée à 15 Mt (mégatonnes), soit près de mille fois celle de la bombe d'Hiroshima. Les Russes ont quant à eux fait encore "mieux" (si l'on peut dire) en 1961, avec la Tsar Bomba et ses 57 mégatonnes (soit l'équivalent de 57 millions de tonnes de TNT !).

Crédit : US government
Cette liste est, bien entendu, loin d'être exhaustive.
Le carbone (Z = 6)
Environ 0,06 % des atomes de l'univers sont des atomes de carbone. C'est très peu dans l'absolu, pourtant
le carbone occupe la 4ème place en terme d'abondance, juste après l'oxygène (0,1 % des atomes), mais
très loin derrière l'hydrogène (92 % des atomes) et l'hélium (8 % des atomes). Le carbone naturel posséde trois
isotopesOn appelle isotopes des atomes ayant le
même nombre de protons, mais qui différent par leur nombre de neutrons. :
le carbone 12 (noté 12C), stable, de très loin le plus abondant (environ 99 % de tout le carbone),
suivi du carbone 13 (13C), stable également mais beaucoup moins abondant (environ 1 %), et enfin le
carbone 14 (14C), qui est radioactif et n'est présent qu'en infimes quantités, à l'état de traces.
Le carbone mérite une place à part. En effet, il forme à lui seul beaucoup plus de molécules (et de très très
loin) que tous les autres éléments réunis, étant à l'origine d'un gigantesque domaine de la chimie appelée
chimie organique. Les molécules les plus complexes, en particulier celles dont sont constitués les
êtres vivants, reposent entièrement sur la chimie du carbone. Tel est le cas notamment des acides aminés,
qui interviennent dans la constitution des protéines, et de l'ADN, molécule géante qui contient notre code
génétique. Pour faire court : pas de carbone, pas de vie.
L'étude du carbone nécessite des milliers de livres à elle seule, aussi nous ne ferons qu'effleurer le sujet,
et encore...
Origine du carbone
Le carbone se forme exclusivement au coeur des "vieilles" étoiles, lorsque celles-ci ont épuisé leurs stocks d'hydrogène et commencent à fusionner leur hélium. Ces étoiles appartiennent à la famille des géantes rouges et, pour être précis, font partie de ce que l'on appelle le red clump (ou "grumeau rouge"). C'est le sort qui attend notre Soleil d'ici quelques milliards d'années.

Crédit : NASA
A ce stade, la température au sein des étoiles atteint allègrement une centaine de millions de degrés, et il s'y produit un ensemble de réactions appelé "réaction triple alpha", au cours desquelles trois noyaux d'hélium (particules "alpha") fusionnent pour donner un noyau de carbone. Nous devons ce scénario, élaboré au début des années 1950, à l'astrophysicien Edwin Salpeter (1924-2008). Au cours de ce processus, il se produit en réalité deux réactions successives faisant intervenir un élément intermédiaire, le béryllium 8.
Première réaction : 4He + 4He ---> 8Be + rayons gammas
Seconde réaction : 4He + 8Be ---> 12C + rayons gammas
Seul problème, les noyaux de 8Be produits lors de la première réaction sont très instables
et se désintègrent quasi-instantanément en redonnant deux atomes d'hélium :
8Be ---> 4He + 4He.
La seconde réaction n'a donc théoriquement aucune chance de se produire, et il ne devrait par conséquent
pas y avoir de carbone (et donc pas de vie) dans l'univers. Sauf que si... L'explication, nous la devons
à l'astronome britanique Fred Hoyle (1915-2001) qui, en 1954, émit l'hypothèse selon laquelle il devait
exister un état excité du carbone 12 (qui se trouve alors porté à un niveau d'énergie plus élevé qu'il ne
devrait), et que cet état augmentait considérablement la probabilté que la seconde réaction ait effectivement
lieu. Ceci sera confirmé ultérieurement par l'astrophysicien américain William Fowler (1911-1995).
Nous revenons de loin...
Le terme "carbone" est issu du latin "carbo", qui signifie braise ou charbon. Sur Terre, il est présent dans le sol sous forme de sédiments (charbon et pétrole), appelés combustibles fossiles, mais également sous forme pure (graphite et diamant).
Le charbon (minerai)
Le charbon !, autrefois appelé charbon de terre (par opposition au charbon de bois), est connu depuis l'Antiquité puisque l'on raconte que lors d'un voyage en Chine, Marco Polo (1254-1324) remarqua que les Chinois faisaient brûler des sortes de pierres noires pour se chauffer et cuire leurs aliments. Il s'agit d'une roche sédimentaire combustible, riche en carbone, hydrogène et oxygène, dont les gisements se sont formés par accumulation de végétaux. Ces derniers, à l'abri de l'air, ont fini par se fossiliser selon un processus appelé méthanisation, au cours d'une période géologique à laquelle on donne le nom de carbonifère (il y a environ 300 - 360 millions d'années).
Il existe plusieurs variétés de charbon, qui peuvent être classées en fonction de leur teneur en carbone. Voyons cela de plus près.
- La tourbe, principal constituant du sol des tourbières, n'est pas un charbon à proprement parler puiqu'elle contient relativement "peu" de carbone (environ 50 %). Par contre, son enfouissement progressif peu mener, dans certaines conditions et sur des périodes suffisamment longues (de l'ordre du million d'années), à sa transformation en charbon. Elle est utilisée comme fertilisant en agriculture, comme combustible (même s'il est médiocre) dans certaines centrales (comme celle de Shatura, près de Moscou), et a été employée au Moyen-Âge comme matériau de construction dans les pays où le bois manquait (par exemple en Islande). Au niveau mondial, les plus gros producteurs de tourbe sont l'Allemagne et le Canada.

de l'Angleterre), en 1905
Crédit : Alexander Eric Hasse
- Le lignite, qui contient entre 55 et 75 % de carbone, est principalement utilisé pour produire de l'électricité. L'Allemagne en est le premier producteur mondial, suivi de la Chine et de la Russie.
- La houille, appelée autrefois charbon de terre, contient de 75 à 90 % de carbone. Elle est employée
comme combustible depuis le XIè siècle. L'Angleterre en fait grand usage dès le début du XVIIè siècle, notamment
pour son industrie verrière, le bois étant réservé à la construction des bateaux. La
pyrolyseLa pyrolyse consiste à décomposer un matériau organique en le portant à
haute température, mais en l'absence d'oxygène afin qu'il ne brûle pas.
de la houille permet d'obtenir du coke, combustible employé dans les hauts-fourneaux dès le début du
XVIIIè siècle, sous l'impulsion du britanique Abraham Darby. Cette réaction de pyrolyse libère également du
goudron ainsi que du gaz de houille (mélange de dihydrogène, de méthane et de monoxyde de carbone),
qui sera utilisé au cours du XIXè siècle comme gaz d'éclairage dans les grandes villes, avant que l'éclairage
électrique ne fasse son entrée en scène.
De nos jours, la houille est essentiellement utilisée pour produire de l'électricité (centrales
thermiques), et pour fabriquer du coke destiné aux hauts-fourneaux. Les plus gros producteurs
mondiaux de houille sont la Chine et les Etats-Unis, mais c'est l'Australie qui reste le premier exportateur.

- L'anthracite, qui contient plus de 90 % de carbone, tire son nom du grec "anthrax" signifiant
"charbon". Il est utilisé comme combustible pour le chauffage domestique, ainsi que dans le traitement de l'eau
où, mélangé à du sable fin, il joue le rôle de filtre. En sidérurgie, il est parfois employé dans les fonderies
car, en raison de sa teneur élevée en carbone, il n'a pas besoin d'être transformé en coke pour être utilisé.
Les principaux gisements se trouvent en Chine, en Australie, en Europe et aux Etats-Unis.
Le charbon de bois
Le charbon de bois est obtenu en carbonisant du bois en l'absence d'oxygène (pyrolyse). La
technique, connue depuis l'Antiquité, consiste à porter le bois à température élevée, tout en l'empêchant de
s'enflammer. Il faut pour cela empiler le bois en formant une sorte de "meule", en laissant un trou central
qui fera office de cheminée. On met ensuite le feu dans la cheminée à l'aide de charbon de bois, on recouvre
le tout d'une épaisse couche de terre, puis on laisse la cuisson agir pendant une bonne quinzaine de jours.
Les images ci-dessous, prises vers 1900 en Forêt-Noire, décrivent ces différentes étapes.




Quand on estime que le charbon de bois est prêt, on ajoute une seconde couche de terre pour
étouffer la combustion, et on attend tranquillement que le tout refroidisse avant de démonter la meule.
Aujourd'hui, la production de charbon de bois est principalement réalisée dans des fours dédiés à cette tâche. Essentiellement utilisé comme combustible pour barbecue, il occupait une place bien plus importante autrefois : on l'utilisait en effet comme combustible dans les hauts fourneaux (avant de le remplacer par le coke) et dans la poudre à canon, mais également comme conservateur alimentaire (pour la viande et les œufs). Et n'oublions pas le domaine artistique : on utilise en effet certaines variétés de charbon de bois pour faire ce que l'on appelle du dessin au "fusain" (du nom d'un petit arbuste), même si l'on fait aujourd'hui plutôt usage de charbon de saule.
Le pétrole
Le pétrole (littéralement "huile de roche") est connu depuis l'Antiquité, car il affleure (il est mis à nu par l'érosion) en certains endroits. Il est alors utilisé pour calfater (rendre étanche) les coques de bateaux, et intervient vraissemblablement dans la composition du feu grégeois, mélange incendiaire inventé au VIIè siècle, utilisé lors des combats navals. Il faut attendre l'année 1859 pour qu'il commence à être extrait par forage, marquant ainsi le début de son exploitation industrielle.

Le pétrole est un mélange complexe d'hydrocarbures (molécules constituées d'atomes de carbone et d'hydrogène) et de substances contenant entre autres de l'azote, du soufre et de l'oxygène. Au total, ce sont des milliers de molécules, plus ou moins complexes, qu'il faut séparer les unes des autres par distillation fractionnée.
Si la majeure partie du pétrole (près de 60 %) est utilisée comme carburant pour alimenter les véhicules (voitures, avions, bateaux...), il est bon de rappeler que la grande majorité des matières plastiques, des textiles synthétiques, des solvants ou des cosmétiques proviennent de la pétrochimie. Le PVC, le polyéthylène, le polystyrène, le polyuréthane, les polyesters, les nylons, le polycarbonate... sont en effet tous fabriqués à partir de pétrole (et il ne s'agit là que d'une petite liste). Sans oublier le fioul, utilisé pour le chauffage et la production d'électricité (centrales thermiques à fioul), ou encore le bitume, qui joue le rôle de liant dans l'asphalte employé pour construire les routes (il assure la cohésion entre les fragments de roche).
Un dernier mot à ce sujet. Les quantités de pétrole s'expriment dans une drôle d'unité de mesure, le baril, qui vaut approximativement 159 litres. Cette unité anglo-saxonne remonte aux années 1870. Elle correspond à la capacité des tonneaux en chêne qui servaient à transporter le whisky, l'huile de baleine, les poissons...
Le graphite
Le graphite
!
tire son nom, inventé en 1789 par le minéralogiste allemand Abraham Gottlob Werner, du grec "graphein"
qui signifie "écrire". Avant cette date, on l'appelait "plombagine" car on pensait qu'il s'agissait d'une
variété de plomb (auquel il ressemble un peu). En 1779, le chimiste suédois Carl Wilhelm Scheele
(1742-1786) parvient à démontrer, en étudiant sa combustion, qu'il s'agit en réalité de carbone.
Il s'agit plus précisément de l'une des deux variétés allotropiques (c'est-à-dire l'une des deux formes
cristallines) du carbone pur que l'on rencontre dans la nature (en réalité, il existe une troisième forme très
rare, la lonsdaléite, découverte en 1967 dans le Meteor Crater en Arizona).
Le graphite, élément natif, présente une structure cristallline constituée de feuillets appelés "graphènes",
qui peuvent facilement glisser les uns sur les autres, ce qui explique les traces que ce dernier laisse sur le
papier. Il se présente sous l'aspect d'un solide noir, relativement mou, conducteur (médiocre) de l'électricité,
dont la température de fusion (ou plutôt de sublimation, étant donné qu'il passe directement à l'état gazeux)
est la plus élevée de la classification périodique, puisqu'elle est d'environ 3 800 °C.

Outre la fabrication des mines de crayons de papiers, le graphite est avant tout utilisé en sidérurgie pour ses qualités réfractaires (creusets, briques). Il est aussi employé en tant que conducteur électrique (électrodes, balais de moteurs, batteries lithium-ion) et comme modérateur (il ralentit les neutrons) dans certains réacteurs nucléaires. Il intervient également dans la fabrication de la fibre de carbone, ainsi que dans la composition de peintures anticorrosives, de lubrifiants industriels, du caoutchouc, et la liste est longue...
Le diamant
Le diamant
!
tiendrait son nom du grec "adamas", qui signifie "dur". Lui aussi est connu depuis la plus haute
Antiquité, son exploitation remontant à près de 3000 ans en Inde, où il est alors considéré comme le "fruit
des étoiles". Dans la Grèce et la Rome antiques, il est assimilé aux "larmes de Dieu".
Le chimiste français Antoine Laurent de Lavoisier (1743-1794) démontre en 1772 que le charbon et le
diamant sont tous deux constitués de carbone.
Le diamant est le matériau naturel le plus dur, mais cette dureté est fonction de son degré de pureté.
Alors que certains peuvent être rayés par le nitrure de bore, ce n'est pas le cas des plus durs d'entre eux,
en particulier ceux qui proviennent des mines de Copeton et Bingara, en Australie. Constitués de carbone pur,
à l'instar du graphite, leur formation nécessite des conditions de température et de pression extrêmes, comme
celles rencontrées entre 150 et 400 km de profondeur dans le manteau terrestre. Ils sont ensuite amenés à la
surface par le magma, via les cheminées volcaniques. D'autres diamants se sont formés lors d'impacts
météoritiques, à partir du graphite présent dans le sol et qui se transforme sous l'effet de la pression
colossale résultant de l'onde de choc. C'est ainsi que le cratère Popigaï, situé au nord de la Sibérie, vieux
d'environ 35 millions d'années, constituerait l'une des plus grandes réserves mondiales de diamants. Et pendant
que nous y sommes, nous allons faire un "petit" saut jusqu'à l'étoile 55 cancri,
étoile binaireUne étoile binaire est un système constitué de deux étoiles
orbitant l'une autour de l'autre, auxquelles on attribue le nom de l'étoile principale, suivi des lettres
A (pour la plus brillante) et B.
située dans la constellation du Cancer, à environ 41 années-lumière de la Terre. Le membre principal de ce
"couple", 55 cancri A, est accompagné de plusieurs exoplanètes. Rien de bien extraordinaire, puisque l'on a
détecté près de 4000 exoplanètes à ce jour, si ce n'est que l'une d'entre elles, 55 Cancri Ae, dont
la masse est assez proche de celle de Neptune, serait constituée de graphite en surface, et de diamant en
profondeur, pour près d'un tiers de sa masse. Il ne s'agit bien entendu que d'une supposition, mais il n'est
pas interdit de rêver.
Quant aux diamants synthétiques, deux procédés permettent de les obtenir : la technique HPHT (haute pression
et haute température) consiste à soumettre de la poudre de carbone à une température de 1400°C et à une
pression de 58 000 bars, tandis que la technique CVD (dépôt chimique en phase vapeur) consiste à faire
croitre un diamant couche après couche, à l'aide de méthane (gaz riche en carbone) et d'hydrogène ionisés.
Ce dernier procédé permet d'obtenir des diamants plus purs qu'avec la méthode HPHT.

Crédit : NASA
Les deux principales utilisations des diamants sont la joaillerie et l'industrie.
En joaillerie, le diamant est considéré comme l'une des quatre pierres précieuses, avec le rubis,
l'émeraude et le saphir. Habituellement incolores, les diamants peuvent contenir des impuretés qui leur
confèrent diverses couleurs : bleu, jaune, rouge... Leur éclat exceptionnel résulte de leur indice de
réfraction très élevé (2,4), ce qui disperse la lumière et donne ce scintillement si particulier (la façon
dont le diamant est taillé joue également un rôle important).
La masse d'un diamant s'exprime en carats, un carat valant exactement 0,2 gramme. A l'heure actuelle,
le plus gros diamant taillé est le Cullinan I, avec une masse de 530 carats, soit 106 grammes. Découvert
en 1905 dans le Transvaal (Afrique du Sud), il provient d'un diamant brut dont la masse initiale était
de 3 106 carats (soit 621 g).
Enfin, l'expression "noces de diamants" est employée pour symboliser 60 ans de mariage.

Crédit : Géry Parent
Dans l'industrie, les diamants sont principalement utilisés comme abrasifs (instruments de forage),
pour faire de la découpe (certains bistouris, employés en chirurgie occulaire, sont en diamant), du meulage
ou du polissage.
A l'heure actuelle, la Russie est le plus gros producteur de diamants (près de 28 % du marché mondial), suivi
du Botswana (15 %), du Canada (15 %) et de l'Australie (11 %).
Bien entendu, le carbone connait bien d'autres applications, mais nous n'aborderons que quelques-unes
d'entre elles et nous nous contenterons de les survoler rapidement.
Quelques exemples d'utilisation du carbone
La fonte et l'acier
Le fer pur est un métal un peu trop fragile pour être employé tel quel, c'est pourquoi on lui ajoute du carbone afin d'améliorer ses propriétés mécaniques, en le rendant plus dur. Selon le pourcentage de carbone, on obtient :
- de l'acier si la teneur en carbone est inférieure à 2 %,

- de la fonte si la teneur en carbone est comprise entre 2 % et 6,7 %.
Le sujet sera abordé plus en détails dans la rubrique consacrée au fer.
La fibre de carbone
La fibre de carbone est généralement fabriquée à partir de polyacrylonitrile (plus simplement PAN), un
polymère faisant partie de la famille des acryliques. Ce dernier est porté à haute température afin d'obtenir
des fibres de carbone pratiquement pures, qui sont ensuite assemblées et tressées pour former une sorte de tissus,
à la fois souple, léger et très résistant. Ce tissus est ensuite employé pour servir de renfort dans des
matériaux composites.
Les applications de la fibre de carbone sont très diverses : nez de la (défunte) navette spatiale, pièces
d'avions de chasse, coques et mats de certains trimarans ou voiliers de compétition, perches de saut à la
perche, cadres de vélos, cannes à pêche, arcs de compétition... Leur principal inconvénient réside dans leur
mauvaise résistance aux chocs et à l'abrasion.
Le graphène et les nanotubes
Le graphène, isolé pour la première fois en 2004, consiste en un feuillet bidimensionnel constitué d'atomes de carbone, assemblés selon un motif hexagonal. Les cristaux de graphite sont constitués d'un empilement régulier de couches de graphène.

Le graphène est un matériau conducteur. Des études montrent qu'à l'avenir, il pourrait remplacer le silicium pour fabriquer des transistors encore plus petits, ouvrant ainsi la voie à des ordinateurs plus rapides et donc plus performants. De plus, ses propriétés mécaniques et chimiques pourraient en faire un matériau de choix pour fabriquer les électrodes de batteries de voitures, ou pour améliorer la résistance à la corrosion en l'incorporant à de la peinture. Et ce n'est là qu'un petit aperçu des possibilités offertes par ce matériau hors du commun, présentant une résistance dix fois supérieure à celle de l'acier tout en étant beaucoup plus léger, ce qui valut à ses découvreurs (André Geim et Kostya Novoselov) d'obtenir le prix Nobel de physique en 2010. Malheureusement, son coût de production reste encore très élevé à l'heure actuelle.
Quant aux nanotubes, découverts en 1991, ils appartiennent à la famille des
fullerènesUn fullerène est une molécule comportant au moins 60 atomes de carbone,
pouvant adopter la forme d'une sphère, d'un tube, d'un anneau... La famille des fullerènes, découverte en 1985,
représente la troisième forme allotropique connue du carbone (en plus du graphite et du diamant)..
Il s'agit là encore de feuillets constitués d'atomes de carbone, enroulés sur eux-mêmes en formant de minuscules
tubes creux (de quelques nanomètres de diamètre), parfois ouverts, parfois fermés à leurs extrémités. Leurs
propriétés mécaniques sont tout bonnement exceptionnelles. C'est ainsi que leur résistance à la traction pourrait
être près de 200 fois plus grande que celle de l'acier, tout en étant six fois plus léger. Certains nanotubes
pourraient même être plus durs que le diamant. Ils sont également bons conducteurs de l'électricité, et
supraconducteurs à basse température. Quant à leurs propriétés chimiques, leur faible réactivité les rend
intéressants dans la mesure où ils pourraient être utilisés pour "enfermer" d'autres molécules, un peu comme
des tubes à essais, mais à l'échelle nanométrique.
Les nanotubes de carbone semblent donc promis à un bel avenir, et ce dans nombre de domaines : vêtements
plus résistants, matériel sportif high-tech plus solide que la fibre de carbone, stockage de l'hydrogène,
réservoirs de lubrifiant pour disques durs, et pourquoi pas fabrication de cables ultra-solides pour un éventuel
(mais peu crédible) futur ascenseur spatial...

Crédit : NASA
Le noir de carbone
Le noir de carbone est une forme amorphe (c'est-à-dire non cristalline) du carbone, qui se présente sous
l'aspect d'une poudre noire, constituée de petites particules formant des agrégats inférieurs à 1 micron.
Autrefois tiré de la suie, le noir de carbone est aujourd'hui obtenu par combustion incomplète de gaz naturel
ou de résidus pétroliers lourds, ce qui permet d'avoir un produit beaucoup plus pur et homogène. La Chine
représente à elle seule plus de 40 % de la production mondiale (14 millions de tonnes en 2018).
Le noir de carbone est surtout utilisé comme charge dans le caoutchouc servant à fabriquer les pneus (raison
pour laquelle ils sont noirs), afin d'améliorer leur résistance à l'usure et leur durée de vie.

Il est également employé comme pigment dans différentes encres (encre d'imprimerie, encre de Chine), dans les toners de photocopieuses, dans certaines peintures pour automobiles... Les plus anciens se souviennent sans doute du papier carbone et des rubans noirs de machines à écrire (je parle d'un temps que les moins de vingt ans...).
Le charbon actif
Le charbon actif est un matériau poreux constitué de carbone pratiquement pur, obtenu à partir de bois (bouleau, hêtre, pin, chêne, tilleul, peuplier), d'écorce de noix de coco, de noyaux d'olives, de bambou, de houille, et j'en passe... Il trouve une multitude d'applications.
- En raison de sa porosité, il est utilisé dans nombre de systèmes de filtrattion (masques à gaz, abris antiatomiques, intérieurs de voitures, hottes de cuisine, cigarettes...). Dans les stations d'épuration, il permet de retenir les bactéries et diverses substances comme les pesticides.
- Il permet de déchlorer l'eau destinée à la fabrication de la bière, et de décaféiner le café.
- En cas d'ingestion de substances toxiques, il peut jouer le rôle d'antidote en absorbant lesdites substances.
- Ses propriétés constipantes font de lui un excellent antidiarrhéique. Il est également fort apprécié dans la lutte contre les flatulences chroniques.
- Toujours en raison de sa porosité, il permet de stocker du dihydrogène.
Carbures de bore, de calcium, de silicium et de tungstène
Le carbure de bore (B4C) est une céramique à peine moins dure que le nitrure de bore, mais plus résistante à l'usure. Plutôt inerte chimiquement (il résiste à l'acide fluorhydrique), il ne fond qu'à 2 300°C alors qu'il est très léger (environ 2,5 g / cm3). Ces qualités font qu'il est souvent employé pour fabriquer des blindages de chars d'assaut et des plaques de gilets pare-balles.

Le carbure de calcium (CaC2) ! est une "pierre" de synthèse qui, au contact de l'eau, libère de l'acétylène (C2H2), gaz combustible utilisé en spéléologie pour alimenter les lampes à acétylène.
Le carbure de silicium (SiC), céramique de synthèse ultradure et réfractaire, est utilisé comme abrasif (meulage, polissage...), dans certains blindages et plaques de gilets pare-balles, dans les disques de freins à hautes performances, et bien d'autres choses encore...
Le carbure de tungstène (WC) est une céramique réfractaire extrêmement dure, très dense (environ 15,6 g/cm3), présentant une grande résistance à l'usure, utilisée pour fabriquer des instruments coupants, des forets, des munitions anti-chars...
Et il ne s'agit là que de quelques exemples...
La datation au carbone 14
Dans la haute atmosphère, les rayons cosmiques, ces particules de (très) haute énergie qui circulent dans l'espace à des vitesses parfois proches de celle de la lumière, entrent en collision avec les molécules d'air, ce qui engendre une chaîne de réactions produisant des neutrons. Ces neutrons sont ensuite capturés par des atomes d'azote 14 (le diazote est le principal constituant de l'air), qui éjectent un de leurs protons et donnent ainsi naissance à des atomes de carbone 14, selon le mécanisme suivant :
14N + 1n (neutron) ---> 14C + 1H (proton)
Les atomes de carbone 14 ainsi formés ne sont pas stables dans le temps. Ils se désintègrent à un rythme tel que dans un échantillon donné, la moitié d'entre eux ont "disparu" au bout de 5730 ans. Au cours de ces désintégrations, chaque atome de carbone 14 concerné voit l'un de ses neutrons se transformer en proton, le tout accompagné de l'éjection d'un électron (on appelle cela la radio-activité "bêta moins"), ce qui a pour conséquence de le retransformer en atome d'azote 14 :
14C ---> 14N + e- (électron)
Ceci étant posé, le principe de la datation au carbone 14 est relativement simple : une plante, un arbre, un animal, absorbent du carbone, lequel contient une infime quantité de carbone 14, dont la proportion reste constante tant qu'ils sont vivants. Par contre, dès qu'ils meurent, la quantité de carbone 14 qu'ils contiennent décroit progressivement au cours du temps, puisque ce dernier n'est plus renouvelé. La mesure du rapport 14C / 12C permet donc en principe, moyennant un certain nombre de précautions, de déterminer la durée écoulée depuis la mort de l'animal (ou de l'arbre) en question. Pour plus de détails, vous pourrez regarder avec profit la vidéo suivante !.
Bon, j'en ai suffisamment dit à propos du carbone...
L'azote (Z = 7)
L'azote fait partie du 15ème groupe (15ème colonne) de la classification périodique, appelé parfois groupe des pnictogènes (du grec "pnigein" signifiant "asphyxier"), auquel appartiennent également le phosphore, l'arsenic, l'antimoine et le bismuth. Il est omniprésent dans notre environnement, puisque l'air en contient près de 78 % en volume (sous forme de molécules de diazote, de formule N2). Dans l'univers, l'azote occupe la sixième place en terme d'abondance (il représente 0,01 % de tous les atomes). Il possède de nombreux isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons., mais seuls deux d'entre eux sont stables : l'azote 14 (14N), de loin le plus abondant (99,64%), et l'azote 15 (15N).
Origine de l'azote
L'azote se forme essentiellement dans le coeur des étoiles plus massives que le Soleil. En effet, alors
qu'au sein du Soleil (et des étoiles moins massives que lui), l'hydrogène est converti en hélium selon une
chaîne de réactions nucléaires appelée
chaine PPLa chaine proton-proton est l'une des principales séries de réactions
nucléaires convertissant l'hydrogène en hélium au coeur des étoiles de masse modeste appartenant à la séquence
principale (le Soleil en fait lui-même partie)
.
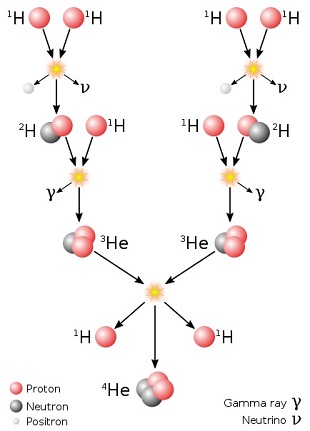 (ou chaîne proton-proton), dans les étoiles plus massives la principale source d'énergie résulte de la
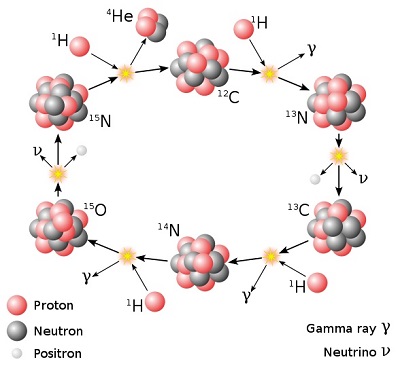
transformation de l'hydrogène en hélium selon un autre cycle de réactions, appelé cycle CNO (ou
cycle carbone-azote-oxygène), qui semble être, pour autant qu'on le sache, le principal mécanisme menant
à la production d'azote. Au cours de ce cycle, les atomes de carbone jouent le rôle de catalyseurs et on
les retrouve à la fin.
(ou chaîne proton-proton), dans les étoiles plus massives la principale source d'énergie résulte de la
transformation de l'hydrogène en hélium selon un autre cycle de réactions, appelé cycle CNO (ou
cycle carbone-azote-oxygène), qui semble être, pour autant qu'on le sache, le principal mécanisme menant
à la production d'azote. Au cours de ce cycle, les atomes de carbone jouent le rôle de catalyseurs et on
les retrouve à la fin.
Un peu d'histoire
Le diazote est isolé en 1772 par le chimiste, médecin et botaniste écossais Daniel Rutherford
(1749-1819), qui refit une expérience déjà réalisée quelques années auparavant par Henry Cavendish
(1731-1810) mais qui eu, contrairement à ce dernier, la bonne idée de faire part de ses résultats à la
communauté scientifique (eh oui, ça marche comme ça).
Nous devons au chimiste français Antoine Laurent de Lavoisier (1743-1794) le nom "azote", issu du
grec "ázôtos" signifiant "invivable" car, contrairement au dioxygène, ce gaz n'entretient pas la vie
des animaux, qui meurent asphyxiés lorsqu'ils respirent du diazote pur. Toutefois, dans les pays anglo-saxons,
on l'appelle "nitrogen" (d'où le symbole N), terme issu du grec "nitron gennan" signifiant "qui engendre
le salpêtre" (ou nitre, de formule KNO3).
Propriétés de l'azote
L'azote sous forme atomique ne peut être obtenu qu'en laboratoire, sous de très faibles pressions. Quant au diazote (N2), il s'agit d'un gaz inerte indispensable à la croissance des plantes, qui le prélèvent principalement dans le sol sous forme d'ions nitrates (NO3-), à l'exception de certaines d'entre elles (luzerne, haricots...) qui le puisent directement dans l'air. Les ions nitrates se forment de façon naturelle sous l'action de certaines bactéries présentes dans le sol, ainsi que lors des orages, les éclairs étant à l'origine de nombreuses réactions chimiques entre le diazote et le dioxygène.

Crédit : U.S. Air Force
L'azote est l'un des principaux constituants des êtres vivants, puisqu'il intervient dans la composition des acides aminés, dont sont constituées les protéines. C'est ainsi qu'un individu de 70 kg contient environ 2,3 kg d'azote.
Gazeux à température ambiante, le diazote passe à l'état liquide si l'on abaisse sa température en dessous de -196°C, et à l'état solide si sa température passe sous la barre des -210°C.
Quelques exemples d'utilisation de l'azote
Le diazote, obtenu principalement par liquéfaction de l'air (à raison de 150 millions de tonnes par an au niveau mondial) trouve nombre d'applications.
- Gaz inerte, il est utilisé pour l'emballage alimentaire (l'absence d'oxygène limite la corrosion et prolonge la durée de conservation des aliments) et, à plus grande échelle, dans certains laboratoires ou musées (là encore à des fins de conservation).
- Il fait office de pesticide "doux", qui asphyxie les organismes indésirables (comme les vers du bois).
- On l'emploie pour le gonflage de pneumatiques subissant de fortes contraintes, notamment dans le domaine de l'aviation et de la formule 1.
- L'azote liquide est utilisé en biologie pour conserver des cellules à très basse température.
- Mélangé à de l'argon et à du dioxyde de carbone, il permet de lutter contre les incendies, en particulier dans les locaux où il y a du matériel informatique.
De nombreuses substances contenant de l'azote, qu'elles soient organiques (riches en carbone) ou inorganiques,
jouent un rôle important dans notre société. Nous allons ici faire plus ample connaissance avec quelques-unes
d'entre elles.
- Si, de nos jours, on utilise encore des engrais d'origine naturelle (guano, fumier, compost...), la majeure partie d'entre eux (nitrate d'ammonium, nitrate de calcium, phosphate d'ammonium, urée...) provient de l'industrie chimique. Or, pour synthétiser ces substances, il faut de l'azote, beaucoup d'azote, qui voit d'ailleurs là sa principale utilisation au niveau mondial.

- L'ammoniac (NH3) est un gros consommateur d'azote. Non seulement il est employé pour produire des engrais, des explosifs, des polymères (plastiques, fibres synthétiques...), mais il est également utilisé comme fluide réfrigérant, comme additif dans le tabac (il augmente l'effet addictif de la nicotine), ou encore comme un moyen de stocker de l'hydrogène. Il tire son nom du dieu égyptien Amon, car à proximité du temple de ce dernier, on extrayait autrefois un minéral, le salmiac, capable d'en libérer. Il faut attendre l'année 1913 pour que le chimiste allemand Fritz Haber (1868-1934) parvienne enfin à le synthétiser directement à partir de dihydrogène et de diazote, ce qui lui vaudra le prix Nobel de chimie en 1918.
- De nombreuses substances riches en azote sont utilisées comme explosifs. Lors de leur combustion, ceux-ci produisent en effet de grandes quantités de diazote, dont les molécules sont extrêmement stables, ce qui a pour conséquence de libérer énormément d'énergie.
- L'hydrazine, de formule N2H4, est utilisé comme carburant pour moteurs de fusées de faible puissance (par exemple pour positionner les satellites sur leurs orbites).
- L'azoture de sodium (NaN3) se présente sous la forme d'une poudre blanche, qui explose violemment en cas d'augmentation brutale de la température. C'est la raison pour laquelle on l'emploie dans les airbags de voiture : en cas de choc, ils gonflent instantanément les coussins en libérant du diazote.
- La nitroglycérine, explosif ô combien célèbre, est également employée comme médicament pour traiter certaines affections cardiovasculaires comme l'angine de poitrine.
- Le protoxyde d'azote (N2O) ou "gaz hilarant", découvert en 1772 par l'anglais Joseph Priestley (1733-1804), est utilisé en chirurgie comme anesthésique ou antalgique. Il est également employé comme gaz propulseur dans les bombes de crème chantilly.

(cette pratique n'est pas sans danger ! )
Crédit : Thomas McLean
- Le nitrure de bore, deuxième élément le plus dur après le diamant mais beaucoup plus résistant à la chaleur, est parfois utilisé comme abrasif pour usiner l'acier.
- Le nitrure de silicium (Si3N4), céramique légère et extrêmement dure,
connaît aujourd'hui un nombre croissant d'applications : bougies de préchauffage des moteurs diesel, roulements
à billes à hautes performances, matériau réfractaire pour tuyères de fusées, isolant électrique, abrasif et
outils de coupe (il s'avère plus performant que le carbure de tungstène)...
L'oxygène (Z = 8)
L'oxygène fait partie du 16ème groupe (16ème colonne) de la classification
périodique, appelé parfois groupe des chalcogènes (du grec "chalcos" signifiant "minerai"),
auquel appartiennent également le soufre, le sélénium, le tellure et le polonium.
Il possède de nombreux
isotopesOn appelle isotopes des atomes ayant le
même nombre de protons, mais qui différent par leur nombre de neutrons.,
mais seuls trois d'entre eux sont stables : l'oxygène 16 (16O), l'oxygène 17 (17O)
et l'oxygène 18 (18O), l'oxygène 16 occupant de très loin la première place (à 99,76 %). Troisième
élément le plus abondant de l'univers (environ 0,1% de tous les atomes) après l'hydrogène et l'hélium, il
est également omniprésent sur Terre, puisqu'il représente à lui seul près de 46 % de la masse de la croûte
terrestre (principalement sous forme de dioxyde de silicium, de carbonates, d'oxydes de fer...). Il constitue
également 21 % de l'air sec et environ 86 % de la masse des océans (pour rappel, la molécule d'eau a pour
formule H2O).

Crédit : NASA - Mission Apollo 17
Origine de l'oxygène
A l'instar du carbone, l'oxygène se forme exclusivement au coeur des "vieilles" étoiles, lorsque celles-ci ont épuisé leurs stocks d'hydrogène et commencent à fusionner leur hélium. Ces étoiles appartiennent alors à la famille des géantes rouges et, pour être précis, font partie de ce que l'on appelle le red clump (ou "grumeau rouge"). Dans un premier temps, de l'hélium est transformé en carbone, puis une partie de ce carbone réagit à son tour avec l'hélium pour donner de l'oxygène 16, selon la réaction suivante :
12C + 4He ---> 16O + rayons gammas
Quant à l'oxygène 17 et à l'oxygène 18, ils sont produits au cours d'une variante du cycle CNO.
Pour rappel, le cycle CNO consiste en une suite de réactions faisant intervenir le carbone 12 (qui joue
le rôle de catalyseur), et qui permet de convertir l'hydrogène en hélium de façon plus efficace que la
chaine PPLa chaine proton-proton est l'une des principales séries de réactions
nucléaires convertissant l'hydrogène en hélium au coeur des étoiles de masse modeste appartenant à la séquence
principale (le Soleil en fait lui-même partie)
.
 (chaîne proton-proton).
(chaîne proton-proton).
A la fin de cette phase, le coeur de l'étoile est essentiellement constitué de carbone et d'oxygène. Quand la température y atteint le milliard de kelvin, les réactions de fusion du carbone prennent le relai, donnant naissance à du sodium 23, du néon 20 et du magnésium 23 :
12C + 12C ---> 23Na + 1p (proton)
12C + 12C ---> 20Ne + 4He
12C + 12C ---> 23Mg + 1n (neutron)
Sous l'action de rayons gammas très énergétiques, une partie des noyaux de néon 20 sont brisés, donnant de l'oxygène 16 et de l'hélium 4 :
20Ne + rayons gammas ---> 16O + 4He
Une autre réaction, faisant cette fois intervenir le carbone 13, produit de l'oxygène 16 :
13C + 4He ---> 16O + neutron
Un peu plus tard, lorsque la température dépasse les deux milliards de kelvin, la fusion de l'oxygène entre en jeu à son tour, mais nous découvrirons cela un peu plus loin.
Un peu d'histoire
Il est difficile d'associer un nom à la découverte de l'oxygène, plusieurs savants ayant apporté leur contribution dans ce domaine. En 1772, le chimiste suédois Carl Wilhelm Scheele (1742-1786) constate qu'en chauffant du salpêtre ou de l'oxyde de mercure, il obtient un gaz qui ravive les combustions, gaz auquel il donne le nom d' "air combustible". En 1774, le pasteur et philosophe anglais Joseph Priestley (1733-1804) décompose à son tour de l'oxyde de mercure et obtient ce qu'il appelle de "l'air déphlogistiqué" (en référence à la théorie du phlogistique, sorte de "principe du feu" qui se dégage lorsque l'on brûle des corps combustibles). Il remarque notamment qu'une souris enfermée dans un bocal renfermant ce gaz est plus active.

par Ozias Humphrey (1742-1810)
C'est toutefois le chimiste français Antoine Laurent de Lavoisier (1743-1794) qui, le premier, donne l'explication correcte de ce qui se passe lors d'une combustion et du rôle joué par le dioxygène, mettant ainsi à mal la théorie du phlogistique. Il confirme également que l'air n'est pas un élément comme on le pensait depuis près de 2000 ans, mais qu'il est en réalité constitué de deux gaz : l'azote (qui tire son nom du grec signifiant "privé de vie") et l' "air vital", auquel il donne rapidement le nom d'oxygène (du grec "oxys" signifiant acide) car il pense (à tort) qu'il intervient dans la composition de tous les acides (c'est le cas des acides nitrique et sulfurique, mais pas de l'acide chlorhydrique, pour ne prendre que ces exemples).
Propriétés de l'oxygène
L'oxygène est avant tout un excellent comburant. Il constitue à ce titre l'un des éléments du triangle du feu, ou plus exactement du tétraèdre du feu, qui doivent être réunis si l'on veut qu'il y ait combustion. Ces éléments sont les suivants :

- Le combustible, c'est ce qui brûle (bois, charbon, essence, méthane...)
- Le comburant est ce qui permet au combustible de brûler (dioxygène, substances riches en oxygène, halogènes...)
- L'énergie d'activation, c'est ce qui permet de déclancher la combustion. Elle peut être apportée par une flamme, un corps incandescent, une étincelle...
- Les radicaux libres sont des molécules instables et très réactives, qui résultent généralement de la rupture de liaisons chimiques. Sans eux, les combustions se produiraient sans qu'il y ait de flammes.
Dans les
CNTPLes CNTP ou conditions normales de température et de pression sont
considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire,
définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013
bars).
(conditions normales de température et de pression), le dioxygène se présente sous forme d'un gaz incolore et
inodore, constitué de molécules ayant pour formule O2. Il se liquéfie (se condense) à -183°C et se
solidifie à -218°C. Sous forme liquide ou solide, il reste transparent, mais présente alors un aspect légèrement
bleuté.
Il est possible d'obtenir de l'oxygène pur à partir de l'air liquide, en effectuant une distillation fractionnée
(voir les deux premières minutes de la vidéo suivante
!).
A l'échelle mondiale, ce sont près de 100 millions de tonnes de dioxygène qui sont ainsi produites chaque
année.

Crédit : Nika Glover, U.S. Air Force
Soluble dans l'eau, le dioxygène permet aux formes de vie aquatiques de se développer et de prospérer. Il est d'ailleurs d'autant plus soluble dans l'eau que celle-ci est froide, ce qui explique la plus grande densité d'espèces vivantes dans les eaux polaires.
Enfin l'oxygène est un élément très corrosif, qui a notamment tendance à oxyder de nombreux métaux (mais pas seulement). L'exemple le plus frappant est celui de la rouille, mélange d'oxydes et d'hydroxydes de fer résultant de l'action combinée de l'oxygène et de l'eau.

Crédit : Alf Van Beem
Quelques exemples d'utilisation de l'oxygène
- L'oxygène est utilisé en métallurgie, notamment pour produire de l'acier à partir de la fonte sortant des hauts fourneaux. Utilisé à la place de l'air depuis les années 1950, l'oxygène permet en effet de décarburer la fonte (retirer le carbone en excès), et d'éliminer la quasi-totalité du phosphore et du soufre qu'elle contient.
- L'oxycoupage permet de découper des métaux à l'aide d'un simple jet de dioxygène pur. Le principe en est très simple. Dans un premier temps, une flamme obtenue à l'aide d'un mélange de dioxygène et d'acétylène permet de porter à haute température (environ 1300°C) l'endroit où l'on veut commencer la découpe. Ensuite, une fois la température d'amorçage atteinte, le jet d'oxygène pur permet d'auto-entretenir la combustion du métal.
- En médecine, l'oxygène est prescrit aux personnes ayant des insuffisances respiratoires (on parle d'oxygénothérapie).
- Vulcain, le moteur-fusée des lanceurs Ariane 5, est alimenté par du dihydrogène et du dioxygène liquides, tandis que les lanceurs Soyouz utilisent le couple d'ergols dioxygène-kérozène (c'était également le cas des Saturne V). Les lanceurs du futur utiliseront quant à eux vraissemblablement le couple dioxygène-méthane.

Crédit : NASA - Bill Ingalls
- Le dioxygène est employé dans les usines de traitement d'eau potable : il permet en effet le développement de certaines bactéries qui décomposent les déchets.
- Il est également employé en chimie dans de très nombreux processus faisant intervenir des oxydations.
- Dans la haute atmosphère, entre 20 et 40 km d'altitude, les rayons ultraviolets émis par le Soleil
sont absorbés par les molécules de dioxygène (O2), qui se brisent aussitôt en libérant des atomes
d'oxygène, qui à leur tour s'unissent à d'autres molécules de dioxygène pour donner du trioxygène (O3),
plus connu sous le nom... d'ozone. Celui-ci joue un rôle essentiel puisqu'il filtre la majeure partie des
rayons ultraviolets provenant du Soleil.
Le phosphore (Z = 15)
Le phosphore fait partie du 15ème groupe (15ème colonne) de la classification périodique, appelé parfois groupe des pnictogènes (du grec "pnigein" signifiant "asphyxier"), auquel appartiennent également l'azote, l'arsenic, l'antimoine et le bismuth. Le phosphore possède 23 isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. connus, mais seul le phosphore 31 (31P) est stable. Pour ce qui est de son abondance dans la croûte terrestre, il arrive en onzième position (en terme de masse).
Origine du phosphore
Lorsque de vieilles étoiles massives (au moins huit masses solaires) arrivent au terme de leur existence, elles finissent, quand la température atteint deux milliards de kelvins dans leur coeur, par réaliser la fusion de l'oxygène. Parmi les nombreuses réactions qui ont alors lieu, certaines produisent du phosphore 31 (31P) et du phosphore 30 (30P) :
16O + 16O ---> 31P + 1p (proton)
16O + 16O ---> 30P + 2H (deutérium)
Cette phase n'augure rien de bon, puisqu'une fois l'oxygène épuisé, la fusion du silicium prend la relève. Cette dernière étape ne dure pas plus d'une journée et sonne le glas de notre étoile, qui termine alors son existence en supernova, phénomène apocalyptique au cours duquel une partie des éléments qu'elle a synthétisés tout au long de sa vie sont dispersés dans l'espace.
Un peu d'histoire
Rendons-nous en Allemagne, plus précisément dans la ville de Hambourg, en l'an 1669, où nous attend un certain Hennig Brandt (1630-1692). Celui-ci, marchand de son état, est passionné par l'alchimie, activité très en vogue à son époque. Il rêve de faire fortune en découvrant le secret de la pierre philosophale. Alors qu'il tente désespérément d'obtenir de l'or à partir de différents métaux, il a soudain une révélation : le pipi ! Sa couleur dorée ne peut signifier qu'une chose : ce liquide doit être la clé qui lui permettra d'atteindre son objectif. Dès lors, il va se mettre à collecter et à faire évaporer des milliers de litres d'urine, ce qui lui permet d'obtenir un résidu de couleur brunâtre. Celui-ci ne lui permet pas de fabriquer de l'or, mais il remarque qu'en chauffant un échantillon de cette substance en présence d'un métal quelconque, il finit par obtenir une pâte blanchâtre dont le comportement est étrange : non seulement cette dernière s'enflamme spontanément au contact de l'air, mais dans l'obscurité, elle émet une douce lueur verdâtre !. Il lui donne le nom de "phosphore", terme construit à partir de la racine grecque "phosphoros", qui signifie littéralement "porteur de lumière".

par Joseph Wright, 1771
Ironie de l'histoire, en 1943, c'est en faisant usage (entre autres) de bombes au phosphore, que les alliés détruiront la ville de Hambourg, au cours de sept raids aériens portant le nom d' "Opération Gomorrhe". Cela coûtera la vie à près de 45 000 civils, mais que voulez-vous, quand on est dans le camp du "Bien", tout est permis.

après l'opération Gomorrhe
Crédit : Royal Air Force
Mais revenons à Brandt à et son urine. En 1674, le chimiste allemand Johann Kunkel parvient à découvrir son secret, et isole le phosphore à son tour. Il sera suivi de peu (en 1679) par le physicien irlandais Robert Boyle (1627-1691). En 1770, les suédois Johan G. Gahn et Carl W. Scheel mettent au point un procédé permettant d'obtenir de grandes quantités de phosphore à partir d'os de boeufs et de moutons. Il faut toutefois attendre l'année 1867 pour que soit mise au point la méthode moderne, basée sur la prodution de phosphore à partir de minerais.
Propriétés du phosphore
Le phosphore existe sous plusieurs formes cristallines (ou formes allotropiques), les plus connues étant le phosphore blanc, le phosphore rouge et le phosphore noir.
Le phosphore blanc, composé de molécules tétraèdriques constituées de 4 atomes
(P4 ),
se présente sous la forme d'un solide ayant une consistance cireuse, de couleur blanc-jaune
!
et dont l'odeur peut faire penser à celle de l'ail. Très inflammable, ses vapeurs sont corrosives, raison pour
laquelle il a été employé comme arme chimique lors des deux premières guerres mondiales. Extrêmement toxique,
son ingestion provoque de graves lésions au foie, et une exposition prolongée peut être à l'origine d'une
nécrose de la mâchoire. Lors de sa combustion, le phosphore blanc donne du pentoxyde de phosphore, substance
très
hygroscopiqueUne substance hygroscopique est une substance qui a la propriété
d'absorber l'humidité de l'air.,
qui au contact de l'eau se transforme en acide phosphorique (H3PO4). Cette même
propriété le rend capable d'absorber l'eau des tissus vivants, et de dissoudre ces derniers.
),
se présente sous la forme d'un solide ayant une consistance cireuse, de couleur blanc-jaune
!
et dont l'odeur peut faire penser à celle de l'ail. Très inflammable, ses vapeurs sont corrosives, raison pour
laquelle il a été employé comme arme chimique lors des deux premières guerres mondiales. Extrêmement toxique,
son ingestion provoque de graves lésions au foie, et une exposition prolongée peut être à l'origine d'une
nécrose de la mâchoire. Lors de sa combustion, le phosphore blanc donne du pentoxyde de phosphore, substance
très
hygroscopiqueUne substance hygroscopique est une substance qui a la propriété
d'absorber l'humidité de l'air.,
qui au contact de l'eau se transforme en acide phosphorique (H3PO4). Cette même
propriété le rend capable d'absorber l'eau des tissus vivants, et de dissoudre ces derniers.
Dans l'obscurité, le phosphore blanc brille en émettant une lueur verdâtre quand il entre en contact avec
de l'oxygène, et il peut s'enflammer spontanément (on dit qu'il est pyrophorique). C'est pour cela
qu'il est généralement conservé dans l'eau, liquide dans lequel il est très peu soluble.
Le phosphore rouge se présente sous la forme d'une poudre de couleur brun-rouge. Il peut être obtenu en chauffant du phosphore blanc à plus de 250°C. Beaucoup moins inflammable que ce dernier, il présente en outre l'avantage de ne pas être toxique. Les atomes de phosphore s'y organisent en longues chaînes, formées à partir des molécules tétraèdriques de phosphore blanc.

Crédit : Tomihahndorf
Dans le phosphore noir, les atomes de phosphore adoptent une structure en feuillets (appelée phosphorène) pouvant faire penser aux feuillets constituant le graphite. Le phosphorène se comporte comme un semi-conducteur, et des études sont actuellement menées pour voir s'il serait possible de l'employer dans des circuits électroniques.
Le phosphore joue un rôle essentiel chez les êtres vivants. Nos cellules (dont les membranes sont constituées de phospholipides) l'emploient comme vecteur d'énergie, grâce aux molécules d'adénosine triphosphate (ATP). Notre ADN contient également du phosphore, ainsi que nos os et nos dents (sous forme de phosphate de calcium). Quant aux plantes, elle ont besoin de phosphates pour assurer leur croissance.
Production industrielle du phosphore
Le phosphore n'existant pas à l'état natif, il provient essentiellement de minerais riches en phosphates,
tels que l'apatite. Egalement présent dans les minerais de fer, il faut absolument l'en retirer car il
péjore les qualités mécaniques de l'acier. Les principaux producteurs mondiaux de phosphate sont la Chine, les
Etats-Unis et le Maroc (qui détient environ un tiers des réserves mondiales).
La production mondiale est d'environ 900 000 tonnes par an, en grande partie obtenues par réduction de
phosphates naturels en présence de coke et de silice, dans un four électrique à l'intérieur duquel règne
une température de 1200-1500°C (on obtient ainsi du phosphore blanc).
Quelques exemples d'utilisation du phosphore
- A la grande honte de certains belligérants, le phosphore blanc a été (et est encore) employé
comme arme chimique, en tant qu'agent incendiaire (il s'avère encore plus "efficace" que le napalm).
Il est également utilisé comme fumigène, en raison de sa capacité à produire de grandes quantités de fumée,
ainsi que dans les balles traçantes.
Les explosions des bombes au phosphore sont assez facile à reconnaître, car elles sont caractérisées par
une multitude de traits blancs lumineux, visibles sur l'image ci-dessous.

sur le navire de guerre USS Alabama en 1921
- Le phosphore rouge est principalement utilisé pour fabriquer les allumettes de sûreté. Contrairement à ce que l'on croit souvent, il ne se trouve pas sur l'allumette elle-même, mais sur le grattoir, mélangé à de la poudre de verre. Quant au bout rouge (ou "bouton") de l'allumette, il est constitué d'un mélange de chlorate de potassium, de sulfure d'antimoine et de phosphate d'ammonium (dont la tige en bois est d'ailleurs imprégnée), auquel on ajoute un peu de colorant rouge pour le côté esthétique, et de la colle pour assurer la cohésion de l'ensemble.
- Le phosphore rouge est également employé dans nombre de dispositifs pyrotechniques, comme les feux d'artifices.
- Les composés organophosphorés sont des substances organiques (donc basées sur la chimie du carbone) comportant au moins un atome de phosphore. Appartiennent à cette catégorie certains pesticides (comme le malathion) et herbicides (le plus connu étant le Roundup). Le gaz sarin, utilisé dans l'attentat du métro de Tokyo (1995) par la secte Aum Shinrikyo, est un composé organophosphoré.
Le phosphore est toutefois principalement employé sous forme de phosphates, provenant
de minerais riches en ions phosphate (PO43-), hydrogénophophate
(HPO32-), dihydrogénophophate, etc...

- Les phosphates sont principalement utilisés en agriculture et en jardinage, puisqu'ils entrent dans la composition des engrais phosphatés.
- Il n'y a pas si longtemps, nos lessives contenaient des phosphates, dont le rôle consistait à empêcher que le calcaire ne se redépose sur les tissus. Interdits en france depuis juillet 2007, leur utilisation dans les lessives est strictement réglementé par l'Union européenne depuis février 2012. Les phosphates contenus dans les eaux usées contribuent en effet au phénomène d'eutrophisation, ce qui se traduit par la prolifération des algues dans les cours d'eau, et par la disparition des autres espèces, les algues consommant tout l'oxygène disponible.
- Les additifs E540 (dihydrogénophosphate de calcium) et E541 (phosphate d'aluminium), sont associés
au bicarbonate de sodium dans les poudres à lever utilisées en boulangerie-pâtisserie.
Le soufre (Z = 16)
Le soufre fait partie du 16ème groupe (16ème colonne) de la classification
périodique, appelé parfois groupe des chalcogènes (du grec "chalcos" signifiant "minerai"),
auquel appartiennent également l'oxygène, le sélénium, le tellure et le polonium. Il possède 25
isotopesOn appelle isotopes des atomes ayant le
même nombre de protons, mais qui différent par leur nombre de neutrons. connus,
parmi lesquels quatre sont stables : le soufre 32 (32S) pour 95 %, le soufre 33 (33S)
pour 0,75 %, le soufre 34 (34S) pour 4,2 % et enfin le soufre 35 (35S) pour 0,02 %.
Le soufre arrive en dixième position en terme d'abondance dans l'univers (0,002 % de tous les atomes). L'eau
de mer (de surface) en contient de grandes quantités (en moyenne 900 mg/L), et il est également relativement
abondant dans la croûte terrestre.

Crédit : Ben Mills
Origine du soufre
Lorsque de vieilles étoiles massives (au moins huit masses solaires) arrivent au terme de leur existence, elles finissent, quand la température atteint deux milliards de kelvins dans leur coeur, par réaliser la fusion de l'oxygène. Parmi les nombreuses réactions qui ont alors lieu, certaines produisent du soufre 31 (31P), instable (avec une période de 2,57 s), et du soufre 32 (32P) :
16O + 16O ---> 31S + 1n (neutron)
16O + 16O ---> 32S + rayons gammas
Dans les étoiles ayant une masse supérieure à dix masses solaires, un autre mécanisme intervient également, entre 3 et 4 milliards de kelvins : les réactions de photodissociation. Les photons gammas sont alors tellement énergétiques qu'ils parviennent à briser des noyaux complexes. C'est ainsi que certains noyaux de silicium 28, sous l'action de ces photons, éjectent des particules alpha (noyau d'hélium 4), qui sont ensuite réabsorbées par d'autres noyaux de silicium 28, produisant ainsi du soufre 32 :
28Si + 4He ---> 32S + rayons gammas
D'autres éléments seront ensuite produits par ce même processus : argon 36, calcium 40, titane 44...
Une fois l'oxygène épuisé au coeur de l'étoile, la fusion du silicium prend la relève durant quelques
heures. Le destin de l'étoile est alors scellé, cette dernière terminant son existence dans une explosion
apocalyptique, au cours duquel une partie des éléments qu'elle a synthétisés tout au long de sa vie sont
dispersés dans l'espace.
Un peu d'histoire
Le soufre existant à l'état natif, il est connu depuis la plus haute Antiquité. Vers 150 av J.-C., l'homme politique et historien romain Caton l'Ancien suggère de l'employer pour protèger la vigne contre les larves de pyrales, faisant de cet élément l'un des plus anciens insecticides connus.

Crédit : Bibliographisches Institut Leipzig
La Bible mentionne le soufre à plusieurs reprises, notamment dans la Genèse, lorsque Yahweh fait tomber une pluie de soufre et de feu sur les villes de Sodome et Gomorrhe.
Au XIè siècle, les Chinois inventent la poudre à canon, mélange de soufre, de charbon de bois et de salpêtre. La recette est décrite dans le Wujing Zongyao, traité militaire écrit en 1044 durant la dynastie des Song du Nord (image ci-dessous).

Il faut toutefois attendre l'année 1777 pour que le chimiste français Antoine Laurent de Lavoisier (1743-1794) considère le soufre comme un élément chimique à part entière.
Propriétés du soufre
Le soufre, lorsqu'il est à l'état de corps simple et dans les CNTPLes CNTP ou conditions normales de température et de pression sont considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire, définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013 bars)., se présente sous l'aspect d'un solide de couleur jaune, qui brûle avec une flamme bleue en libérant du dioxyde de soufre (SO2), gaz incolore mais toxique et très irritant.

Crédit : Parent Géry
Il s'agit de l'élément présentant le plus de formes allotropiques (c'est-à-dire de formes
cristallines ou moléculaires), que ce soit à l'état solide, liquide ou gazeux, la forme la plus répandue
étant le cyclo-octasoufre (S8),
molécule constituée de huit atomes de soufre formant une boucle. Dans la nature, le soufre est présent dans
nombre de minéraux, sous forme de sulfures ou de sulfates, mais on le trouve également à
l'état natif, en particulier à proximité de certains volcans.
(S8),
molécule constituée de huit atomes de soufre formant une boucle. Dans la nature, le soufre est présent dans
nombre de minéraux, sous forme de sulfures ou de sulfates, mais on le trouve également à
l'état natif, en particulier à proximité de certains volcans.
En raison de ses nombreuses formes allotropiques, le soufre adopte un comportement pour le moins étrange
lorsqu'on le chauffe. Alors qu'il est encore à l'état solide, un premier changement s'opère à 95°C : de
jaune clair (soufre dit "alpha"), il devient jaune foncé (soufre "beta"). Arrivé à 115°C, il passe à l'état
"liquide", sa viscosité continuant à diminuer jusqu'à 155°C. Puis, à partir de 160°C, le processus s'inverse :
il devient de plus en plus pâteux, le maximum de viscosité étant atteint à 190°C (en raison d'une polymérisation
des atomes de soufre). Il prend alors une teinte brun foncé, mais finit par redevenir liquide au fur et à mesure
que la température augmente. Enfin, il entre en ébullition à 445°C.
Io, l'un des quatres satellites galiléensLes satellites galiléens sont les quatre plus gros satellites de Jupiter, à savoir (par ordre d'éloignement) Io, Europe, Ganymède et Callisto. Il ont été observés pour la première fois en janvier 1610 par le savant italien Galilée, et nommés ainsi par l'astronome allemand Simon Marius. de Jupiter, présente un aspect bien étrange, qui lui vaut parfois le surnom de "pizza volante". La raison en est simple : cet astre possède de nombreux volcans très actifs, qui "crachent" des quantités considérables de soufre et d'oxyde de soufre, tous deux responsables de cette étonnante palette de couleurs.

Crédit : NASA / JPL / University of Arizona
A l'exception des gaz rares, le soufre est susceptible de former des composés avec pratiquement tous les autres éléments. C'est ainsi qu'il réagit plus ou moins rapidement (parfois à froid, parfois à chaud) avec les métaux comme le cuivre, l'argent, le mercure, le zinc, l'aluminium, l'étain, le fer, le chrome, le nickel, le cobalt... A l'état liquide, il réagit brutalement avec certains alcalins et alcalinoterreux (lithium, sodium, magnésium). En dehors de l'iode, il se combine facilement avec les halogènes, allant jusqu'à s'enflammer spontanément en présence de fluor. Il peut également se combiner à l'hydrogène, donnant ainsi du sulfure d'hydrogène (H2S), gaz toxique dont l'odeur nauséabonde évoque celle des oeufs pourris.
Le soufre occupe une place importante chez les être vivants. Il entre notamment dans la composition de
certaines enzymes, ainsi que dans celle de deux acides aminés, la cystéine et la méthionine. Dans le
corps, il est essentiellement stocké dans les ongles, les cheveux et les os, contribuant à la solidité de ces
derniers (il favorise l'absorption du calcium, du magnésium et du phosphore). Certaines bactéries vont même
jusqu'à utiliser le soufre comme source d'énergie, en réduisant les ions sulfate (SO32-)
en sulfure d'hydrogène (H2S).
L'ail contient des composés soufrés, responsables de son goût et de son odeur si particuliers. Quant
aux propriétés lacrimales des oignons, ce sont également des composés soufrés qui en sont à l'origine.
En effet, les oignons ont la fâcheuse habitude de puiser le soufre contenu dans le sol, et de le stocker
dans leurs cellules. Lorsque, sous l'action du couteau, ces cellules sont dérichées, une suite de réactions
chimiques aboutit à la formation d'oxyde de propanethial, gaz irritant qui, au contact des yeux, se
transforme en... acide sulfurique.

Crédit : Wallace Keck
Dans le monde animal, les mouffettes, petites créature inoffensives, ont trouvé un moyen de défense assez original. Quand elles se sentent menacées, elles projettent sur leur adversaire un liquide malodorant constitué d'un mélange de thiols, substances riches en soufre plus connues sous le nom de mercaptans. Ce sont également des thiols que l'on retrouve dans les célèbres "boules puantes".
Production industrielle du soufre
En 2017, près de 87 millions de tonnes de soufre étaient produites au niveau mondial. Ce soufre a bien entendu plusieurs origines :
- environ 70 % de la production est obtenue à partir du sulfure d'hydrogène provenant du gaz naturel (Canada, Russie), et du soufre contenu dans le pétrole brut (Etats-Unis, Arabie Saoudite…) ainsi que dans les sables bitumineux (Canada),
- un peu plus de 6 % provient de soufre à l'état natif (Etats-Unis, pologne, Irak, Russie),
- près de 34 % du soufre provient des sulfures contenus dans divers minéraux, tels les pyrites (FeS2) (Chine, Finlande, Russie).

Crédit : John Vachon
Quelques exemples d'utilisation du soufre
- Dans l'industrie, la majeure partie du soufre (environ 85 %) est utilisée pour synthétiser de l'acide
sulfurique, qui intervient lui-même dans nombre de processus industriels, en particulier la fabrication
des engrais, qui consomment à eux seuls près de 60 % de la production de soufre (sous forme de sulfate
de calcium).
L'acide sulfurique intervient également dans l'élaboration de détergents, dans le blanchiment de la pâte
à papier, dans le raffinage du pétrole, dans l'industrie textile, en métallurgie (comme décapant ou solvant),
et j'en passe...
- En viticulture et en horticulture, le soufre est utilisé comme fongicide pour lutter contre l'oidium (ou pourriture blanche), champignon susceptible de proliférer sur un grand nombre de plantes, lorsque le temps est chaud et humide.

Crédit : Roger Griffith
- En 1885, un nouveau traitement est utilisé en viticulture, la bouillie bordelaise, mélange de sulfate de cuivre et de chaux. Son rôle : protéger la vigne contre le tout dernier fléau, le mildiou de la vigne, champignon importé du continent américain, qui fit son apparition en Aquitaine en 1878.

Crédit : Gallica Digital Library
- La vulcanisation du caoutchouc, invention généralement portée au crédit de l'américain Charles Goodyear (1800-1860), consiste à incorporer du soufre dans le caoutchouc afin d'en améliorer les qualités, le rendant notamment beaucoup plus élastique et plus résistant à la chaleur (sans quoi, il a tendance à devenir visqueux et à se déformer). Goodyear aurait découvert le procédé par hasard en 1839, en faisant tomber par inadvertance un échantillon de caoutchouc contenant du soufre dans une poêle. On raconte que dans un geste de colère, il aurait balancé le tout par la fenêtre, dans la neige (nous sommes alors en hiver), et constaté que le morceau de caoutchouc refroidi aurait acquis les propriétés tant recherchées. Toujours est-il que malgré sa découverte, Charles Goodyear finira dans la plus extrême pauvreté, croulant littéralement sous les dettes.

Crédit : William G. Jackman
- Le bout rouge (ou "bouton") des allumettes de sûreté contient su soufre, sous forme de sulfure d'antimoine.
- Du tétrahydrothiophène, ou plus simplement THT, gaz à l'odeur désagréable, est ajouté aux alcanes (méthane, butane...) pour en détecter les fuites. Sa formule, C4H8S, indique clairement la présence de soufre.
- Le bisulfite de calcium intervient dans la fabrication de la pâte à papier, à partir de copeaux de bois. Il est également utilisé comme additif alimentaire (E227).
- Le soufre est largement utilisé en médecine. Ses vertus antiseptiques et décongestionnantes en font un allier précieux pour lutter contre les problèmes de la sphère ORL (rhumes, sinusites...). Il est employé pour traiter les maladies de peau comme l'eczéma et le psoriasis, ainsi que l'acné juvénile. Il présente également des proporiétés anti-inflammatoires, utilisées pour soulager les douleurs rhumatismales. Et n'oublions pas la pénicilline, médicament employé dans le traitement de certaines infections bactériennes, dont la molécule contient un atome de soufre.
- Les sulfites sont utilisés comme additifs alimentaires. Non seulement ils permettent une meilleure conservation des aliments (et du vin), mais ils sont également utilisés comme colorants : ce sont eux qui sont responsables de la belle couleur rose du jambon, qui normalement devrait être gris, ce qui est moins appétissant.
Il y aurait encore bien des choses à raconter au sujet du soufre, mais il n'est pas tout seul...
Le sélénium (Z = 34)
Le sélénium fait partie du 16ème groupe (16ème colonne) de la classification périodique, appelé parfois groupe des chalcogènes (du grec "chalcos" signifiant "minerai"), auquel appartiennent également l'oxygène, le soufre, le tellure et le polonium. Il possède 30 isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. connus, parmi lesquels six sont stables : le sélénium 74 (74Se), le sélénium 76 (76Se), le sélénium 77 (77Se), le sélénium 78 (78Se), le sélénium 80 (80Se) et le sélénium 82 (82Se). L'isotope le plus abondant est le sélénium 80 (pratiquement 50%), suivi du sélénium 78 (environ 24%). On en trouve relativement peu sur Terre : souvent présent à l'état de traces dans les sulfures naturels, il est moins abondant que l'argent dans la croûte terrestre, et il n'occupe que la 34ème place dans l'eau de mer.
Origine du sélénium
Le sélénium est produit, à l'instar du brome et du krypton, par capture de neutrons lors d'explosions de supernovae à effondrement de cœur (supernovae de type II) ou de fusions d'étoiles à neutrons (kilonovae). Le mécanisme qui intervient ici est appelé processus r, la lettre r signifiant qu'il s'agit d'un processus de capture rapide, nécessitant un flux de neutrons très élevé.

Un peu d'histoire
le sélénium est découvert en 1817 par le chimiste suédois Jöns Jacob Berzelius et son assistant Johan Gottlieb Gahn, dans un résidu boueux provenant de la préparation de l'acide sulfurique. Pensant d'abord qu'il a affaire à du tellure (isolé en 1798 par Martin Heinrich Klaproth), Berzelius se ravise lorsqu'il comprend qu'il s'agit en fait d'un nouvel élement. Comme le tellure tire son nom de la déesse romaine Tellus, l'équivalent de Gaïa (la Terre) chez les grecs, il fut décidé de nommer ce nouvel élément sélémium, en référence à Séléné, déesse de la Lune dans la mythologie grecque.
Propriétés du sélénium
Le sélénium existe sous plusieurs formes allotropiques, c'est-à-dire cristallines, les plus courantes étant les formes noire, grise et rouge, où les atomes de sélénium s'organisent de différentes façons. Dans la forme grise, majoritaire car plus stable, ils peuvent former de longues chaînes pouvant en contenir plus de mille. Photosensible, le sélénium gris devient légèrement conducteur de l'électricité lorsqu'il est exposé à la lumière (nous y reviendrons).

Crédit : Tomihahndorf
D'une densité proche de 4,8 g/cm3 à 20°C, le sélénium gris fond à 221°C, se transformant alors en un liquide noir et visqueux. Assez réactif, il s'associe facilement aux halogènes, à l'oxygène ou encore aux métaux, donnant naissance à des composés aux propriétés proches de celles des composés soufrés (n'oublions pas que le soufre et le sélénium appartiennent à la même famille, celle des chalcogènes).
Le sélénium est un oligoélément présent à l'état de traces dans le corps humain. Il se retrouve dans la chaîne
alimentaire car il est capté dans le sol par certains végétaux (noix du Brésil, poix chiches, lentilles, poivrons
rouges...). On en trouve également dans les oeufs, les rognons, l'ail, le thon, le homard...
Impliqué dans le métabolisme des hormones thyroïdiennes, il contribuerait au bon fonctionnement du système immunitaire
et aurait des propriétés antioxydantes. Une carence en sélénium est responsable de la maladie de Keshan, caractérisée
par des lésions du myocarde. A contrario, il s'avère toxique à fortes doses, pouvant entraîner nausées, diarrhées,
fragilisation des ongles et perte des cheveux.
Production industrielle du sélénium
Comme il n’existe pas à proprement parler de gisement de sélénium celui-ci est, à l'instar du tellure, récupéré
principalement lors du traitement de minerais riches en sulfure de cuivre. Lors de l'étape consistant à purifier le
cuivre par électrolyse, il se forme des boues résiduelles contenant (entre autres) du sélénium et du tellure,
mélangées à du cuivre. Pour récupérer le sélénium, il faut traiter ces boues par grillage (vers 500-600°C), le plus
souvent en présence d'acide sulfurique.
Il se forme dans un premier temps du dioxyde de sélénium à l'état gazeux :
Cu2Se + 6 H2SO4 ---> SeO2(g) + 2 CuSO4(s) + 6 H2O(g) + 4 SO2(g)
Le dioxyde de sélénium est ensuite réduit par le dioxyde de soufre :
SeO2(g) + 2 SO2(g) + 2 H2O(liq) ---> Se(s) + 2 H2SO4(liq)
Les principaux producteurs de sélénium sont la Chine (largement en tête, avec 1300 tonnes en 2022), le Japon, la Russie, l'Allemagne et la Belgique (200 t en 2022).
Quelques exemples d'utilisation du sélénium
- Une fine couche de sélénium (du trisélénure d'arsenic pour être exact) recouvre le tambour (cyclindre) des photocopieurs, tambour sur lequel est diffusée une charge électrostatique positive. Dans le noir, le sélénium est isolant, mais il devient conducteur en présence de lumière, ce qui permet d'éliminer la charge électrique. La poudre noire contenue dans le toner, chargée négativement, est attirée uniquement par les régions du tambour où la charge électrique est restée (donc dans les zones d'ombre), avant d'aller se déposer sur les feuilles de papier que l'on souhaite imprimer. Dans les appareils récents, le sélénium a toutefois tendance à être remplacé par le silicium.
- Certaines cellules photovoltaïques dites "couches minces" sont constituées de couches très fines de diséléniure de cuivre et d'indium. Leur rendement est assez médiocre, mais elles présente l'avantage d'être peu coûteuses.
- En photographie, des posemètresUn posemètre est un appareil qui permet de mesurer la luminosité afin de déterminer le meilleur temps de pose. au sélénium ont été utilisés dans les années 1950-60.
- En verrerie, le sélénium permet de masquer la couleur verte du verre (due à la présence de fer).
- Le pigment appelé rouge de cadmium est un sélénio-sulfure de cadmium.
J'en oublie certainement, mais est-ce grave ?
Astronomie pour les myopes -
Mentions légales