Le fluor (Z = 9)
Premier élément du groupe des halogènes (du grec "hals" signifiant "sels"), le fluor possède dix-huit isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons., mais un seul d'entre eux est stable, le fluor 19 (19F), qui est de ce fait le seul à être présent sur Terre. On en trouve dans divers minéraux (fluorite !, cryolite, fluorapatite...), ainsi que dans le charbon et l'argile.
Origine du fluor
Le fluor 19 est essentiellement produit dans le coeur des étoiles plus massives que le Soleil, au cours
d'une variante du cycle CNO. Pour rappel, le cycle CNO consiste en une suite de réactions faisant
intervenir le carbone 12 (qui joue le rôle de catalyseur), et qui permet de convertir l'hydrogène en hélium
de façon plus efficace que la
chaine PPLa chaine proton-proton est l'une des principales séries de réactions
nucléaires convertissant l'hydrogène en hélium au coeur des étoiles de masse modeste appartenant à la séquence
principale (le Soleil en fait lui-même partie)
.
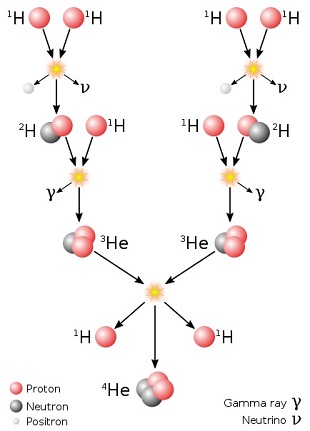 (chaîne proton-proton). Regardons cela de plus près.
(chaîne proton-proton). Regardons cela de plus près.
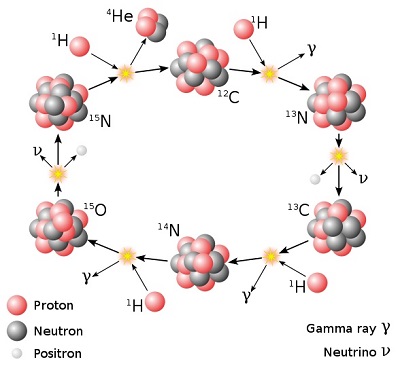
A la fin du cycle CNO "standard", on voit (en haut à gauche) que de l'azote 15 (15N) réagit avec un proton (1H) pour donner un noyau d'hélium et un noyau de carbone 12. Enfin, c'est ce qui se produit la plupart du temps. Mais il arrive que l'azote 15 forme, avec ce proton, un noyau d'oxygène 16, qui réagit à son tour avec un proton pour donner un noyau de fluor 17 (instable), qui se désintègre en donnant de l'oxygène 17 qui, réagissant à son tour avec un proton, donne (parfois) du fluor 18 (instable), qui se désintègre en donnant de l'oxygène 18 qui, enfin, donne (en réagissant avec un proton) du fluor 19 selon le mécanisme suivant :
18O + 1H ---> 19F + rayons gammas
Oufff... Tout cela pour dire qu'au coeur des étoiles, les choses sont loin d'être simples. D'autant moins simples que ce mécanisme produit en réalité très peu de fluor, pas assez en tout cas pour expliquer l'abondance de cet élément. Il faut donc trouver autre chose. L'une des pistes envisagées est celle de la supernova, cet événement cataclysmique qui se produit quand une étoile massive (au moins huit masses solaires) arrive en fin de vie. L'étoile libère alors une quantité colossale de neutrinos, suffisamment énergétiques pour provoquer des réactions de spallation, au cours desquelles de gros noyaux sont brisés pour en donner de plus petits. Eh bien lorsque ces neutrinos arrachent un proton à un noyau de néon, on obtient... du fluor.
Un peu d'histoire
Le fluor tire son nom du latin "fluor" signifiant "écoulement". Son existence est attestée dès 1530 par le saxon Georgius Agricola (1494-1555), père de la minéralogie et de la métallurgie (à laquelle il consacre l'ouvrage "De Re Metallica"). Observant les points communs entre les acides muriatique (chlorhydrique) et fluorique (fluorhydrique), André Marie Ampère (1775-1836) suggère en 1810 l'existence d'un nouvel élément auquel il donne le nom de fluor. En raison de sa très grande réactivité (qui le rend presque impossible à isoler), la quête de cet élément insaisissable occupera les chimistes pendant une bonne partie du XIXè siècle. Il faut attendre l'année 1886 pour qu'enfin le pharmacien français Henri Moissan (1852-1907) parvienne à l'isoler par électrolyse du fluorure de potassium (KF). Cette découverte lui vaut le prix Nobel de chimie en 1906.

Crédit : Generalstabens litografiska anstalt
Propriétés du fluor
Le fluor est le plus réactif de tous les éléments chimiques, et il n'y a que l'hélium et le néon avec
lesquels il ne donne aucun composé connu à ce jour. Le corps simple du fluor est, dans les
CNTPLes CNTP ou conditions normales de température et de pression sont
considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire,
définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013
bars).,
un gaz très toxique et irritant de couleur jaune pâle, le difluor (F2). Il s'agit d'un
oxydant très puissant, capable de réagir avec le sable et le verre, ce qui oblige à le conserver dans des
récipients en téflon. Il réagit de façon explosive avec le dihydrogène, et bien qu'il ne soit pas inflammable,
il peut produire une flamme lorsqu'il entre en contact avec d'autres substances (par exemple avec le soufre).
Sa température d'ébullition est de -188°C, et il se solidifie à -220°C.
Production industrielle du fluor
Chaque année, ce sont près de 20 000 tonnes de difluor (F2) qui sont produites au niveau mondial. Celui-ci est obtenu à partir de fluorine (ou spath fluor), espèce minérale composée de fluorure de calcium (CaF2), première source naturelle de fluor, dont les principaux gisements sont situés en Afrique du Sud, en Chine et au Mexique (où se trouve la mine la plus importante, celle de Las Cuevas, près de San Luis de Potosi). Les réserves mondiales de fluorine sont estimées à plus de 230 millions de tonnes.

Si la fluorine contient plus de 97 % de fluorure de calcium (on dit alors qu'elle est de "qualité acide"), on l'attaque à l'aide d'acide sulfurique pur à 100 %, ce qui permet de produire du fluorure d'hydrogène (HF) :
CaF2 + H2SO4 ---> CaSO4 + 2 HF
Celui-ci, après ajout d'un peu de fluorure de potassium (KF), est ensuite décomposé par électrolyse. On obtient alors du dihydrogène (à la cathode) et du difluor (à l'anode) :
2 HF ---> H2 + F2
Quelques exemples d'utilisation du fluor
Toujours en raison de son extrême réactivité, le fluor n'est jamais utilisé pur. Par contre, ses composés trouvent de nombreuses applications (la petite liste ci-dessous est loin d'être exhaustive).
- Il entre dans la composition du polytétrafluoroéthylène (ou PTFE), commercialisé sous le nom de Téflon, utilisé notamment comme revêtement dans les poêles anti-adhésives.
- Les gaz frigorifiques chlorofluorocarbonés (CFC), plus connus sous le nom de Fréons, contiennent du fluor. Ils ne sont aujourd'hui plus employés dans les systèmes de réfrigération, car ils sont soupçonnés de contribuer à la destruction de la couche d'ozone.

marque Frigidaire.
Par N. C. Wyeth
- Dans le domaine nucléaire, l'hexafluorure d'uranium (UF6) permet de séparer les différents isotopes de l'uranium par diffusion gazeuse et ultracentrifugation, afin de d'enrichir ce dernier en uranium 235 (235U), utilisé comme "combustible" dans les centrales nucléaires.
- L'acide fluorhydrique est utilisé pour attaquer le verre (à des fins de polissage ou de gravure), pour le raffinage du pétrole, ou encore pour décaper les métaux. Il est également employé pour convertir l'uranium en hexafluorure d'uranium, et permet la synthèse du Téflon et du Fréon.
- Des fluorures sont ajoutés dans le sel de table et dans le dentifrice, afin de protéger contre les caries dentaires.

- La cryolite, minerai de formule Na3AlF6, intervient dans la production de l'aluminium. Ajoutée à la poudre d'alumine provenant de la bauxite, elle permet d'en abaisser la température de fusion (vers 960°C, au lieu de 2040°C). Le mélange ainsi obtenu est ensuite soumis à un courant électrique très intense (environ 400 000 ampères !), ce qui permet d'en extraire l'aluminium par électrolyse.

du Groënland
- Le fluor est utilisé dans certaines armes chimiques, comme le gaz sarin (qui fut employé dans l'attentat du métro de Tokyo, perpétré en 1995 par la secte Aum Shinrikyo).
- Le chlorhydrate de fluoxétine est un psychotrope utilisé comme antidépresseur dans certains médicaments (comme le Prozac).
- Le fluor est à l'origine de la substance la plus inflammable que l'on connaisse, le trifluorure de chlore
(ou ClF3), liquide jaune verdâtre (du moins à température ambiante) synthétisé en 1931 par les chimistes
allemands Otto Ruff et Herbert Krug. Extrêmement dangereux, il s'enflamme spontanément au contact de la plupart des
matières organiques (donc de la peau), il réagit violemment avec l'eau, avec le verre, et attaque même le béton.
Cette facheuse tendance à s'enflammer avec tout et n'importe quoi fait qu'on ne lui a trouvé que très peu d'usages
(il intervient dans la synthèse du pentafluorure de chlore, parfois employé pour propulser certains missiles).
Astronomie pour les myopes -
Mentions légales