L'oxygène (Z = 8)
L'oxygène fait partie du 16ème groupe (16ème colonne) de la classification
périodique, appelé parfois groupe des chalcogènes (du grec "chalcos" signifiant "minerai"),
auquel appartiennent également le soufre, le sélénium, le tellure et le polonium.
Il possède de nombreux
isotopesOn appelle isotopes des atomes ayant le
même nombre de protons, mais qui différent par leur nombre de neutrons.,
mais seuls trois d'entre eux sont stables : l'oxygène 16 (16O), l'oxygène 17 (17O)
et l'oxygène 18 (18O), l'oxygène 16 occupant de très loin la première place (à 99,76 %). Troisième
élément le plus abondant de l'univers (environ 0,1% de tous les atomes) après l'hydrogène et l'hélium, il
est également omniprésent sur Terre, puisqu'il représente à lui seul près de 46 % de la masse de la croûte
terrestre (principalement sous forme de dioxyde de silicium, de carbonates, d'oxydes de fer...). Il constitue
également 21 % de l'air sec et environ 86 % de la masse des océans (pour rappel, la molécule d'eau a pour
formule H2O).

Crédit : NASA - Mission Apollo 17
Origine de l'oxygène
A l'instar du carbone, l'oxygène se forme exclusivement au coeur des "vieilles" étoiles, lorsque celles-ci ont épuisé leurs stocks d'hydrogène et commencent à fusionner leur hélium. Ces étoiles appartiennent alors à la famille des géantes rouges et, pour être précis, font partie de ce que l'on appelle le red clump (ou "grumeau rouge"). Dans un premier temps, de l'hélium est transformé en carbone, puis une partie de ce carbone réagit à son tour avec l'hélium pour donner de l'oxygène 16, selon la réaction suivante :
12C + 4He ---> 16O + rayons gammas
Quant à l'oxygène 17 et à l'oxygène 18, ils sont produits au cours d'une variante du cycle CNO.
Pour rappel, le cycle CNO consiste en une suite de réactions faisant intervenir le carbone 12 (qui joue
le rôle de catalyseur), et qui permet de convertir l'hydrogène en hélium de façon plus efficace que la
chaine PPLa chaine proton-proton est l'une des principales séries de réactions
nucléaires convertissant l'hydrogène en hélium au coeur des étoiles de masse modeste appartenant à la séquence
principale (le Soleil en fait lui-même partie)
.
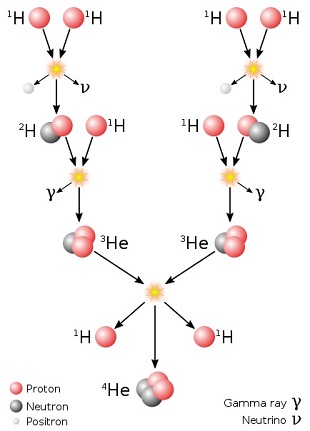 (chaîne proton-proton).
(chaîne proton-proton).
A la fin de cette phase, le coeur de l'étoile est essentiellement constitué de carbone et d'oxygène. Quand la température y atteint le milliard de kelvin, les réactions de fusion du carbone prennent le relai, donnant naissance à du sodium 23, du néon 20 et du magnésium 23 :
12C + 12C ---> 23Na + 1p (proton)
12C + 12C ---> 20Ne + 4He
12C + 12C ---> 23Mg + 1n (neutron)
Sous l'action de rayons gammas très énergétiques, une partie des noyaux de néon 20 sont brisés, donnant de l'oxygène 16 et de l'hélium 4 :
20Ne + rayons gammas ---> 16O + 4He
Une autre réaction, faisant cette fois intervenir le carbone 13, produit de l'oxygène 16 :
13C + 4He ---> 16O + neutron
Un peu plus tard, lorsque la température dépasse les deux milliards de kelvin, la fusion de l'oxygène entre en jeu à son tour, mais nous découvrirons cela un peu plus loin.
Un peu d'histoire
Il est difficile d'associer un nom à la découverte de l'oxygène, plusieurs savants ayant apporté leur contribution dans ce domaine. En 1772, le chimiste suédois Carl Wilhelm Scheele (1742-1786) constate qu'en chauffant du salpêtre ou de l'oxyde de mercure, il obtient un gaz qui ravive les combustions, gaz auquel il donne le nom d' "air combustible". En 1774, le pasteur et philosophe anglais Joseph Priestley (1733-1804) décompose à son tour de l'oxyde de mercure et obtient ce qu'il appelle de "l'air déphlogistiqué" (en référence à la théorie du phlogistique, sorte de "principe du feu" qui se dégage lorsque l'on brûle des corps combustibles). Il remarque notamment qu'une souris enfermée dans un bocal renfermant ce gaz est plus active.

par Ozias Humphrey (1742-1810)
C'est toutefois le chimiste français Antoine Laurent de Lavoisier (1743-1794) qui, le premier, donne l'explication correcte de ce qui se passe lors d'une combustion et du rôle joué par le dioxygène, mettant ainsi à mal la théorie du phlogistique. Il confirme également que l'air n'est pas un élément comme on le pensait depuis près de 2000 ans, mais qu'il est en réalité constitué de deux gaz : l'azote (qui tire son nom du grec signifiant "privé de vie") et l' "air vital", auquel il donne rapidement le nom d'oxygène (du grec "oxys" signifiant acide) car il pense (à tort) qu'il intervient dans la composition de tous les acides (c'est le cas des acides nitrique et sulfurique, mais pas de l'acide chlorhydrique, pour ne prendre que ces exemples).
Propriétés de l'oxygène
L'oxygène est avant tout un excellent comburant. Il constitue à ce titre l'un des éléments du triangle du feu, ou plus exactement du tétraèdre du feu, qui doivent être réunis si l'on veut qu'il y ait combustion. Ces éléments sont les suivants :

- Le combustible, c'est ce qui brûle (bois, charbon, essence, méthane...)
- Le comburant est ce qui permet au combustible de brûler (dioxygène, substances riches en oxygène, halogènes...)
- L'énergie d'activation, c'est ce qui permet de déclancher la combustion. Elle peut être apportée par une flamme, un corps incandescent, une étincelle...
- Les radicaux libres sont des molécules instables et très réactives, qui résultent généralement de la rupture de liaisons chimiques. Sans eux, les combustions se produiraient sans qu'il y ait de flammes.
Dans les
CNTPLes CNTP ou conditions normales de température et de pression sont
considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire,
définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013
bars).
(conditions normales de température et de pression), le dioxygène se présente sous forme d'un gaz incolore et
inodore, constitué de molécules ayant pour formule O2. Il se liquéfie (se condense) à -183°C et se
solidifie à -218°C. Sous forme liquide ou solide, il reste transparent, mais présente alors un aspect légèrement
bleuté.
Il est possible d'obtenir de l'oxygène pur à partir de l'air liquide, en effectuant une distillation fractionnée
(voir les deux premières minutes de la vidéo suivante
!).
A l'échelle mondiale, ce sont près de 100 millions de tonnes de dioxygène qui sont ainsi produites chaque
année.

Crédit : Nika Glover, U.S. Air Force
Soluble dans l'eau, le dioxygène permet aux formes de vie aquatiques de se développer et de prospérer. Il est d'ailleurs d'autant plus soluble dans l'eau que celle-ci est froide, ce qui explique la plus grande densité d'espèces vivantes dans les eaux polaires.
Enfin l'oxygène est un élément très corrosif, qui a notamment tendance à oxyder de nombreux métaux (mais pas seulement). L'exemple le plus frappant est celui de la rouille, mélange d'oxydes et d'hydroxydes de fer résultant de l'action combinée de l'oxygène et de l'eau.

Crédit : Alf Van Beem
Quelques exemples d'utilisation de l'oxygène
- L'oxygène est utilisé en métallurgie, notamment pour produire de l'acier à partir de la fonte sortant des hauts fourneaux. Utilisé à la place de l'air depuis les années 1950, l'oxygène permet en effet de décarburer la fonte (retirer le carbone en excès), et d'éliminer la quasi-totalité du phosphore et du soufre qu'elle contient.
- L'oxycoupage permet de découper des métaux à l'aide d'un simple jet de dioxygène pur. Le principe en est très simple. Dans un premier temps, une flamme obtenue à l'aide d'un mélange de dioxygène et d'acétylène permet de porter à haute température (environ 1300°C) l'endroit où l'on veut commencer la découpe. Ensuite, une fois la température d'amorçage atteinte, le jet d'oxygène pur permet d'auto-entretenir la combustion du métal.
- En médecine, l'oxygène est prescrit aux personnes ayant des insuffisances respiratoires (on parle d'oxygénothérapie).
- Vulcain, le moteur-fusée des lanceurs Ariane 5, est alimenté par du dihydrogène et du dioxygène liquides, tandis que les lanceurs Soyouz utilisent le couple d'ergols dioxygène-kérozène (c'était également le cas des Saturne V). Les lanceurs du futur utiliseront quant à eux vraissemblablement le couple dioxygène-méthane.

Crédit : NASA - Bill Ingalls
- Le dioxygène est employé dans les usines de traitement d'eau potable : il permet en effet le développement de certaines bactéries qui décomposent les déchets.
- Il est également employé en chimie dans de très nombreux processus faisant intervenir des oxydations.
- Dans la haute atmosphère, entre 20 et 40 km d'altitude, les rayons ultraviolets émis par le Soleil
sont absorbés par les molécules de dioxygène (O2), qui se brisent aussitôt en libérant des atomes
d'oxygène, qui à leur tour s'unissent à d'autres molécules de dioxygène pour donner du trioxygène (O3),
plus connu sous le nom... d'ozone. Celui-ci joue un rôle essentiel puisqu'il filtre la majeure partie des
rayons ultraviolets provenant du Soleil.
Astronomie pour les myopes -
Mentions légales