L'azote (Z = 7)
L'azote fait partie du 15ème groupe (15ème colonne) de la classification périodique, appelé parfois groupe des pnictogènes (du grec "pnigein" signifiant "asphyxier"), auquel appartiennent également le phosphore, l'arsenic, l'antimoine et le bismuth. Il est omniprésent dans notre environnement, puisque l'air en contient près de 78 % en volume (sous forme de molécules de diazote, de formule N2). Dans l'univers, l'azote occupe la sixième place en terme d'abondance (il représente 0,01 % de tous les atomes). Il possède de nombreux isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons., mais seuls deux d'entre eux sont stables : l'azote 14 (14N), de loin le plus abondant (99,64%), et l'azote 15 (15N).
Origine de l'azote
L'azote se forme essentiellement dans le coeur des étoiles plus massives que le Soleil. En effet, alors
qu'au sein du Soleil (et des étoiles moins massives que lui), l'hydrogène est converti en hélium selon une
chaîne de réactions nucléaires appelée
chaine PPLa chaine proton-proton est l'une des principales séries de réactions
nucléaires convertissant l'hydrogène en hélium au coeur des étoiles de masse modeste appartenant à la séquence
principale (le Soleil en fait lui-même partie)
.
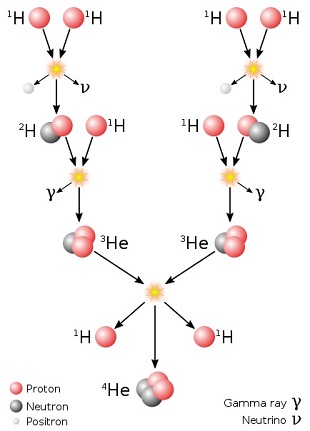 (ou chaîne proton-proton), dans les étoiles plus massives la principale source d'énergie résulte de la
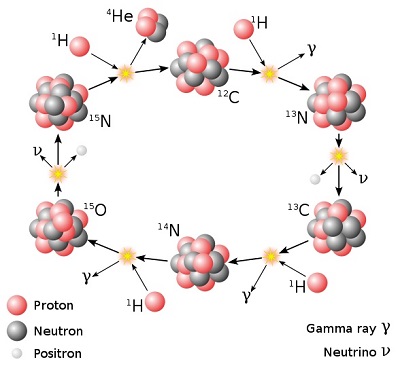
transformation de l'hydrogène en hélium selon un autre cycle de réactions, appelé cycle CNO (ou
cycle carbone-azote-oxygène), qui semble être, pour autant qu'on le sache, le principal mécanisme menant
à la production d'azote. Au cours de ce cycle, les atomes de carbone jouent le rôle de catalyseurs et on
les retrouve à la fin.
(ou chaîne proton-proton), dans les étoiles plus massives la principale source d'énergie résulte de la
transformation de l'hydrogène en hélium selon un autre cycle de réactions, appelé cycle CNO (ou
cycle carbone-azote-oxygène), qui semble être, pour autant qu'on le sache, le principal mécanisme menant
à la production d'azote. Au cours de ce cycle, les atomes de carbone jouent le rôle de catalyseurs et on
les retrouve à la fin.
Un peu d'histoire
Le diazote est isolé en 1772 par le chimiste, médecin et botaniste écossais Daniel Rutherford
(1749-1819), qui refit une expérience déjà réalisée quelques années auparavant par Henry Cavendish
(1731-1810) mais qui eu, contrairement à ce dernier, la bonne idée de faire part de ses résultats à la
communauté scientifique (eh oui, ça marche comme ça).
Nous devons au chimiste français Antoine Laurent de Lavoisier (1743-1794) le nom "azote", issu du
grec "ázôtos" signifiant "invivable" car, contrairement au dioxygène, ce gaz n'entretient pas la vie
des animaux, qui meurent asphyxiés lorsqu'ils respirent du diazote pur. Toutefois, dans les pays anglo-saxons,
on l'appelle "nitrogen" (d'où le symbole N), terme issu du grec "nitron gennan" signifiant "qui engendre
le salpêtre" (ou nitre, de formule KNO3).
Propriétés de l'azote
L'azote sous forme atomique ne peut être obtenu qu'en laboratoire, sous de très faibles pressions. Quant au diazote (N2), il s'agit d'un gaz inerte indispensable à la croissance des plantes, qui le prélèvent principalement dans le sol sous forme d'ions nitrates (NO3-), à l'exception de certaines d'entre elles (luzerne, haricots...) qui le puisent directement dans l'air. Les ions nitrates se forment de façon naturelle sous l'action de certaines bactéries présentes dans le sol, ainsi que lors des orages, les éclairs étant à l'origine de nombreuses réactions chimiques entre le diazote et le dioxygène.

Crédit : U.S. Air Force
L'azote est l'un des principaux constituants des êtres vivants, puisqu'il intervient dans la composition des acides aminés, dont sont constituées les protéines. C'est ainsi qu'un individu de 70 kg contient environ 2,3 kg d'azote.
Gazeux à température ambiante, le diazote passe à l'état liquide si l'on abaisse sa température en dessous de -196°C, et à l'état solide si sa température passe sous la barre des -210°C.
Quelques exemples d'utilisation de l'azote
Le diazote, obtenu principalement par liquéfaction de l'air (à raison de 150 millions de tonnes par an au niveau mondial) trouve nombre d'applications.
- Gaz inerte, il est utilisé pour l'emballage alimentaire (l'absence d'oxygène limite la corrosion et prolonge la durée de conservation des aliments) et, à plus grande échelle, dans certains laboratoires ou musées (là encore à des fins de conservation).
- Il fait office de pesticide "doux", qui asphyxie les organismes indésirables (comme les vers du bois).
- On l'emploie pour le gonflage de pneumatiques subissant de fortes contraintes, notamment dans le domaine de l'aviation et de la formule 1.
- L'azote liquide est utilisé en biologie pour conserver des cellules à très basse température.
- Mélangé à de l'argon et à du dioxyde de carbone, il permet de lutter contre les incendies, en particulier dans les locaux où il y a du matériel informatique.
De nombreuses substances contenant de l'azote, qu'elles soient organiques (riches en carbone) ou inorganiques,
jouent un rôle important dans notre société. Nous allons ici faire plus ample connaissance avec quelques-unes
d'entre elles.
- Si, de nos jours, on utilise encore des engrais d'origine naturelle (guano, fumier, compost...), la majeure partie d'entre eux (nitrate d'ammonium, nitrate de calcium, phosphate d'ammonium, urée...) provient de l'industrie chimique. Or, pour synthétiser ces substances, il faut de l'azote, beaucoup d'azote, qui voit d'ailleurs là sa principale utilisation au niveau mondial.

- L'ammoniac (NH3) est un gros consommateur d'azote. Non seulement il est employé pour produire des engrais, des explosifs, des polymères (plastiques, fibres synthétiques...), mais il est également utilisé comme fluide réfrigérant, comme additif dans le tabac (il augmente l'effet addictif de la nicotine), ou encore comme un moyen de stocker de l'hydrogène. Il tire son nom du dieu égyptien Amon, car à proximité du temple de ce dernier, on extrayait autrefois un minéral, le salmiac, capable d'en libérer. Il faut attendre l'année 1913 pour que le chimiste allemand Fritz Haber (1868-1934) parvienne enfin à le synthétiser directement à partir de dihydrogène et de diazote, ce qui lui vaudra le prix Nobel de chimie en 1918.
- De nombreuses substances riches en azote sont utilisées comme explosifs. Lors de leur combustion, ceux-ci produisent en effet de grandes quantités de diazote, dont les molécules sont extrêmement stables, ce qui a pour conséquence de libérer énormément d'énergie.
- L'hydrazine, de formule N2H4, est utilisé comme carburant pour moteurs de fusées de faible puissance (par exemple pour positionner les satellites sur leurs orbites).
- L'azoture de sodium (NaN3) se présente sous la forme d'une poudre blanche, qui explose violemment en cas d'augmentation brutale de la température. C'est la raison pour laquelle on l'emploie dans les airbags de voiture : en cas de choc, ils gonflent instantanément les coussins en libérant du diazote.
- La nitroglycérine, explosif ô combien célèbre, est également employée comme médicament pour traiter certaines affections cardiovasculaires comme l'angine de poitrine.
- Le protoxyde d'azote (N2O) ou "gaz hilarant", découvert en 1772 par l'anglais Joseph Priestley (1733-1804), est utilisé en chirurgie comme anesthésique ou antalgique. Il est également employé comme gaz propulseur dans les bombes de crème chantilly.

(cette pratique n'est pas sans danger ! )
Crédit : Thomas McLean
- Le nitrure de bore, deuxième élément le plus dur après le diamant mais beaucoup plus résistant à la chaleur, est parfois utilisé comme abrasif pour usiner l'acier.
- Le nitrure de silicium (Si3N4), céramique légère et extrêmement dure,
connaît aujourd'hui un nombre croissant d'applications : bougies de préchauffage des moteurs diesel, roulements
à billes à hautes performances, matériau réfractaire pour tuyères de fusées, isolant électrique, abrasif et
outils de coupe (il s'avère plus performant que le carbure de tungstène)...
Astronomie pour les myopes -
Mentions légales