L'hélium (Z = 2)
Bien que l'on en trouve que très peu sur Terre, l'hélium est, après l'hydrogène, le second élément le plus abondant dans l'univers : en effet, près de 8 % des atomes sont des atomes d'hélium (ce qui représente près de 24 % de la masse totale).
Remarque : il sera ici uniquement question de l'hélium 4, isotopeOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. stable de l'hélium dont le noyau est constitué de 2 protons et de 2 neutrons (donc de 4 nucléonsDu latin "nucleus" signifiant "noyau", les nucléons sont les composants des noyaux atomiques, autrement dit les protons et les neutrons. On appelle nombre de masse, noté A, le nombre de nucléons que contient un atome.).
Origine de l'hélium
Cela fait près de treize milliards d'années que des quantités colossales d'hydrogène sont transformées en hélium dans le cœur des étoiles. Pour prendre l'exemple du Soleil, en son sein, ce sont chaque seconde 619 millions de tonnes d'hydrogène qui "disparaissent" pour donner naissance à 614 millions de tonnes d'hélium, et ce depuis des milliards d'années. Pourtant, malgré ces chiffres impressionnants, l'abondance de l'hélium ne peut être expliquée par ce seul mode de formation : il y en a beaucoup trop ! La solution a été apportée en 1948, dans un article intitulé "The Origin of Chemical Elements", plus connu sous le nom d'article "alpha beta gamma" en raison du nom de ses auteurs : Ralph Alpher, Hans Bethe et George Gamow (en réalité, Bethe n'a pas contribué à sa rédaction mais son ami Gamow, qui avait l'esprit très facétieux, ajouta son nom à seule fin de faire un jeu de mot). Et que dit cet article ? Il dit que lors des premières minutes qui ont suivi le Big Bang, les conditions de température et de pression étaient telles qu'elles ont permis la synthèse de grandes quantités d'hélium. Cette fois-ci, le compte y est. La "nucléosynthèse primordiale", puisque tel est le nom donné à cet événement, est d'ailleurs considérée comme l'un des trois piliers sur lesquels repose la théorie du Big Bang (les deux autres piliers étant l'expansion de l'univers et le rayonnement de fond cosmologique).
Un peu d'histoire
L'histoire de la découverte de l'hélium est pour le moins étonnante : ce dernier a en effet été détecté pour la première fois dans le Soleil, bien avant de l'être sur Terre. Comment est-ce possible ? Grâce à la spectroscopie, cet outil incontournable qui permet, entre autres choses, d'analyser la composition chimique des étoiles (mais pas seulement...).

Crédit : NASA
En 1814, l'opticien et physicien allemand Joseph von Fraunhofer (1787-1823) confirme l'existence de raies sombres (observées quelques années plus tôt par l'anglais William Wollaston) dans le spectre du Soleil, raies qui portent depuis le nom de raies de Fraunhofer. Leur nature est restée mystérieuse jusqu'à ce que, dans les années 1860, un physicien (Gustav Kirchhoff) et un chimiste (Robert Bunsen), tous deux allemands, trouvent l'explication : ces raies sont la signature des éléments chimiques présents dans le Soleil. Il est donc possible, contrairement à ce qu'affirmait le philosophe Auguste Comte, d'analyser la composition chimiques des astres (étoiles, nébuleuses...) à distance.

Crédit : Volkssternwarte Regensburg
C'est ainsi que, par comparaison avec des raies spectrales obtenues artificiellement en
laboratoire, on réussit à mettre en évidence dans l'atmosphère du Soleil la présence de sodium,
de cuivre, de calcium, de magnésium, d'hydrogène, de fer, de titane, de nickel, de cobalt, et j'en
passe... Toutefois, lors de l'éclipse totale de Soleil du 18 août 1868, l'astronome français Jules
Janssen (1824-1907) découvre dans le spectre d'émission (constitué de raies lumineuses) de la
chromosphèreLa chromosphère correspond à la basse atmosphère du
Soleil. Elle est comprise entre la photosphère (surface visible du Soleil) et la
couronne (partie haute de l'atmosphère solaire, visible lors des éclipses totales
de Soleil).
du Soleil, une raie jaune qui ne correspond à aucun élément chimique répertorié sur Terre. Quelques
mois plus tard, c'est au tour de l'astronome anglais Norman Lockyer (1836-1920) d'observer
cette fameuse raie jaune. Il en profite d'ailleurs pour baptiser le mystérieux élément qui en est
à l'origine : il l'appelle hélium, en référence à Hélios, dieu du Soleil dans la mythologie
grecque.
Il faudra attendre près de 27 ans (jusqu'en mars 1895 pour être exact) avant qu'un chimiste anglais,
William Ramsay (1852-1916), ne parvienne à détecter la présence d'hélium dans des roches
terrestres, au cours de l'analyse d'un échantillon de clévéite, un minerai riche en uranium.

Production industrielle de l'hélium
La radioactivité naturelle due à l'uranium et au thorium est à l'origine de la formation d'hélium dans la croûte terrestre, car ces éléments émettent des particules alpha (autrement dit des noyaux d'hélium) lors de leur désintégration. L'hélium ainsi produit peut s'accumuler dans des poches formées par des roches imperméables, mélangé à du gaz naturel (qui peut en contenir jusqu'à 7 %). En 2019, la production mondiale d'hélium s'élevait à environ 160 millions de m3, parmi lesquels 89 millions de m3 étaient dus aux seuls Etats-Unis, détenteurs des principaux gisements (notamment au Kansas, au Texas et en Oklahoma).
Propriétés de l'hélium
Premier élément du groupe des gaz nobles, l'hélium est totalement inerte chimiquement : on ne
lui connait aucun composé stable, du moins dans les
CNTPLes CNTP ou conditions normales de température et de pression sont
considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire,
définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013
bars).
(conditions normales de température et de pression). Regardons plutôt du côté de ses propriétés
physiques, si l'on ne veut pas s'ennuyer. Tout d'abord, il s'agit du gaz le plus léger après le
dihydrogène, avec sur ce dernier l'immense avantage de ne pas être inflammable. Ensuite, il s'agit de
l'élément dont la température de liquéfaction est la plus basse : - 269°C ! Entre - 269 et - 271°C, il
se présente sous la forme d'un liquide incolore appelé "hélium I", mais c'est en dessous de - 271°C que
les choses deviennent vraiment intéressantes. Il passe alors dans un nouvel état liquide, appelé "hélium
II", où il perd toute viscosité et n'oppose plus aucune résistance à l'écoulement, devenant ce que l'on
appelle un superfluide. Pour faire court, un superfluide est un liquide au comportement hors
norme. Jugez plutôt ! Quand on verse de l'eau (ou n'importe quel liquide) dans un verre, elle reste
bien sagement au fond (à condition bien entendu d'être au repos). Normal. Sauf qu'un superfluide aura
tendance, lui, à "grimper" tout seul le long des parois du verre et à s'en échapper
!.
Autre bizarrerie, quand on met sur le feu une casserole remplie d'eau, l'eau qui est au fond chauffe,
se dilate, devient plus légère, ce qui la fait remonter à la surface tandis que de l'eau plus froide
prend sa place, chauffe à son tour, se dilate, remonte à la surface, et ainsi de suite... Cela
s'appelle la convection. Avec l'hélium superfluide, rien de tout cela : la chaleur se propage
uniquement par conduction, et ce quasi-instantanément (à près de 20 m/s). Dans un superfluide,
la température sera donc à tout instant partout la même, empêchant ainsi tout mouvement de convection.
Outre son caractère superfluide à basse température, l'hélium est la seule substance qui reste liquide
à pression normale jusqu'au zéro absolu, soit -273,16°C.
Quelques exemples d'utilisation de l'hélium
- Etant près de sept fois moins dense que l'air, l'hélium est employé pour gonfler les ballons de baudruche si chers aux enfants, les dirigeables et la plupart des ballons sondes, envoyés en altitude afin d'étudier l'atmosphère et la météorologie.

Crédit : U.S. Navy
- Les atomes d'hélium sont tellement petits qu'ils diffusent facilement à travers les parois fines ou poreuses (cela explique pourquoi les ballons de baudruche gonflés à l'hélium finissent par retomber), ou les joints dont l'étanchéité est imparfaite. C'est la raison pour laquelle ce gaz est parfois utilisé pour détecter les fuites dans les réservoirs à haute pression.
- L'hélium liquide est utilisé pour maintenir à très basse température les aimants supraconducteursUn supraconducteur est un matériau qui, en dessous d'une certaine température (généralement très basse), voit sa résistance électrique devenir nulle., utilisés notamment dans les appareils d'IRM, ou encore au LHC (Large Hadron Collider), ce grand accélérateur de particules situé à proximité de Genève, qui nécessite à lui seul une centaine de tonnes d'hélium liquide maintenu à une température de -271°C.
- Il permet d'assurer le transport et l'évacuation de la chaleur dans certains types de réacteurs nucléaires refroidis au gaz.
- Il est utilisé comme atmosphère protectrice lors de la fabrication des circuits intégrés et des fibres optiques.
- En plongée sous-marine à grande profondeur, l'air comprimé est remplacé par un mélange d'hélium et
de dioxygène, appelé "Héliox". Le diazote, principal constituant de l'air (à près de 78 %), présente en effet
un gros défaut. Etant soluble dans le sang, il a tendance à s'y accumuler au fur et à mesure que l'on descend
et que la pression augmente, et au-delà d'une quarantaine de mètres de profondeur (variable selon les personnes),
il est responsable d'un phénomène appelé narcose ou ivresse des profondeurs, qui peut se traduire
pas divers symptômes : euphorie, angoisse, troubles de la vision, réflexes ralentis... autant de désagréments
qui sont supprimés lorsqu'on le remplace par de l'hélium (du moins jusqu'à une certaine profondeur, car l'hélium
peut à son tour poser problème). Mais ceci n'est pas un site de plongée...
Un dernier point : les personnes qui parlent après avoir inhalé de l'hélium ont une "voix de canard". Cela vient
du fait que la célérité (vitesse) du son est environ trois fois plus grande dans l'hélium (1007 m/s à 20°C) que
dans l'air (343 m/s à 20°C).

... en 1858.
Crédit : Le Monde illustré, n°48
- Les lasers hélium-néon, tout premiers à avoir été inventés (en 1960), ont longtemps été utilisés dans les lecteurs de code-barres (avant d'être remplacés par les lasers à diode).
- Dans certaines fusées, la pressurisation des réservoirs d'ergols peut être assurée par un gaz inerte, généralement de l'hélium ou du diazote.
- L'hélium est également employé comme gaz d'emballage (additif alimentaire E939), afin d'empêcher l'oxydation des aliments et le développement de micro-organismes.
Il y aurait encore bien des choses à dire à propos de l'hélium et de ses propriétés, mais la place
manque, malheureusement...
Le néon (Z = 10)
Le néon est un gaz rare, présent en très faible quantité sur Terre, puisqu'on ne le trouve qu'à l'état de traces dans l'atmosphère (0,0018 % en volume). Il s'agit pourtant de l'un des éléments les plus abondants de l'univers (0,012 % de tous les atomes sont des atomes de néon), puisqu'il occupe la cinquième place derrière l'hydrogène, l'hélium, l'oxygène et le carbone. Il existe trois isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. stables du néon dans la nature : le 20Ne, le 21Ne et le 22Ne, le plus abondant des trois étant de loin le néon 20 (20Ne), qui représente à lui seul environ 90 % de tout le néon.
Origine du néon
Le néon est produit par certaines étoiles suffisamment massives (au moins cinq masses solaires) pour permettre, après la fusion de l'hélium en carbone (et en oxygène), celle du carbone en sodium 23 (23Na), en néon 20 (20Ne), et en magnésium 23 (23Mg) (la température au coeur de l'étoile atteint alors le milliard de kelvins) :
12C + 12C ---> 23Na + 1p (proton)
12C + 12C ---> 20Ne + 4He
12C + 12C ---> 23Mg + 1n (neutron)
Un peu d'histoire
Le néon a été découvert en 1898 par les chimistes britaniques William Ramsay (à qui l'on doit également la découverte de l'hélium, de l'argon, du xénon et du krypton !) et Morris William Travers, qui le nomment à partir du grec "néos" signifiant "nouveau". Ce gaz trouvera rapidement une application, le fameux tube au néon, inventé en 1910 par le physicien et chimiste français Georges Claude (1870-1960).
Propriétés du néon
Le néon est un gaz monoatomique un peu plus léger que l'air, chimiquement inerte, dont la température de liquéfaction est de -246°C. Lorsqu'il est soumis à une décharge électrique, il produit une lumière de couleur rouge-orangée.

Crédit : Pslawinski
Production industrielle du néon
En 2017, 360 000 m3 de néon ont été produits (par distillation de l'air) au niveau mondial, principalement par les Etats-Unis (46 %), l'Ukraine (30 %) et la Chine (24 %).
Quelques exemples d'utilisation du néon
En 2017, près de 360 000 m3 de néon pur ont été produits au niveau mondial, mais celui-ci ne trouve que peu d'applications pratiques :
- Il est principalement utilisé dans les tubes au néon des enseignes publicitaires, et bien que les tubes fluorescents employés pour l'éclairage domestique ne contiennent pas de néon mais de l'argon et de la vapeur de mercure, l'appellation "Néon" est restée.
- Certains lasers, utilisés en chirurgie oculaire ou pour fabriquer des circuits intégrés, font appel au néon.
- Le néon est parfois utilisé comme liquide cryogénique.
C'est peu, mais il va falloir nous en contenter.
L'argon (Z = 18)
Bien qu'il soit considéré comme un gaz rare, l'argon est relativement abondant dans l'atmosphère, dont
il représente 1,3 % de la masse, occupant ainsi la troisième place derrière le diazote (78 %) et le dioxygène
(21 %).
L'argon possède 24
isotopesOn appelle isotopes des atomes ayant le
même nombre de protons, mais qui différent par leur nombre de neutrons.
connus, mais seuls trois sont stables : l'argon 36 (36Ar), l'argon 38
(38Ar) et l'argon 40 (40Ar). Dans l'atmosphère terrestre, on trouve essentiellement de
l'argon 40 (pour 99,6 %), issu de la désintégration du potassium 40 (radioactif) présent dans le sol. Quant
aux étoiles, elles fabriquent principalement de l'argon 36 (36Ar), faisant de ce dernier l'isotope
de l'argon le plus abondant dans l'univers (environ 84 %).
Origine de l'argon
Lorsque des étoiles très massives (au moins dix masses solaires) arrivent en fin de vie, la température dans leur coeur ne cesse de grimper, jusqu'à atteindre 3 à 4 milliards de kelvins. Les photons gammas sont alors tellement énergétiques qu'ils parviennent à briser des noyaux complexes. On parle de réactions de photodissociation. C'est ainsi que certains noyaux de silicium 28, sous l'action de ces photons, éjectent des particules alpha (noyau d'hélium 4) :
28Si + rayons gamma --> 24Mg + 4He
Ces particules alpha sont ensuite réabsorbées par d'autres noyaux de silicium 28, produisant ainsi du soufre 32 et de l'argon 36 selon le mécanisme suivant :
28Si + 4He ---> 32S + rayons gammas
32S + 4He ---> 36Ar + rayons gammas
Ce même mécanisme va ensuite se répéter pour donner naissance à d'autres éléments (calcium 40, titane 44...), mais nous y reviendrons en temps voulu.
Un peu d'histoire
En 1785, le physicien et chimiste britanique Henry Cavendish soupçonne la présence dans l'air d'un gaz inconnu et inerte chimiquement, mais il faut attendre l'année 1894 pour que Lord Rayleigh et William Ramsay (à qui l'on doit également la découverte de l'hélium, du néon, du xénon et du krypton !) ne confirment l'existence de ce nouvel élément, auquel ils donnent le nom d'argon, tiré du grec "argós" signifiant "oisif", "paresseux", l'argon se montrant vraiment peu enclin à réagir avec les autres éléments.
Propriétés de l'argon
L'argon est un gaz monoatomique un peu plus dense que l'air. Sa température de liquéfaction est de -186°C. Lorsqu'il est soumis à une décharge électrique, il produit une douce lumière de couleur rosâtre.
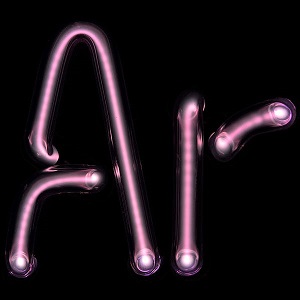
Crédit : Pslawinski
Bon isolant thermique, l'argon est totalement inerte chimiquement, à l'instar des autres gaz nobles. Il présente toutefois sur ces dernier l'avantage d'être beaucoup moins onéreux.
Production industrielle de l'argon
L'argon, dont la température d'ébullition est de -186°C, est obtenu par distillation fractionnée de l'air liquide, procédé qui permet de récupérer près de 90 % de l'argon contenu dans l'air.
Quelques exemples d'utilisation de l'argon
- Une atmosphère d'argon est parfois requise pour les procédés à haute température, en raison de son inertie chimique plus importante que celle de l'azote. C'est le cas notamment dans les fours où il y a des électrodes en graphites, dont il faut bien entendu empêcher la combustion.
- Toujours en raison de son inertie chimique, l'argon est parfois utilisé comme gaz protecteur dans le soudage à l'arc (il crée une enveloppe protectrice autour de l'arc électrique).
- C'est triste, mais l'argon est utilisé pour asphyxier les volailles dans les élevages, afin de les faire "partir" sans douleur.

par Van Schendel
- Dans le domaine médical, des lasers à argon trouvent nombre d'applications : chirurgie oculaire, destruction de tumeurs, sutures d'artères...
- En tant qu'atmosphère protectrice empêchant l'oxydation, l'argon est également utilisé comme conservateur pour les aliments (viande, vin), ainsi que pour les vernis et les peintures.
- La méthode de datation par le potassium-argon est employée pour estimer l'âge de roches formées
à partir de magmas entièrement dégazés, en mesurant les quantités relatives de potassium 40 et d'argon 40
qu'elles contiennent. On part de l'hypothèse selon laquelle au moment de sa formation, la roche contient
du potassium 40 (isotope radioactif), mais pas d'argon. Une fois que le magma est solidifié, le potassium
40 se désintègre progressivement (avec une
périodeLa période ou demi-vie d'un isotope radio-actif correspond à
la durée au bout de laquelle la moitié des noyaux de cet isotope se sont désintégrés.
de 1,25 milliards d'années) en libérant de l'argon 40 qui s'accumule progressivement dans la roche. Donc,
plus le temps passe, moins il y a de potassium 40 et plus il y a d'argon 40. Les formules mathématiques
font le reste...
Le krypton (Z = 36)
Le krypton est un gaz rare (noble), présent à l'état de traces dans l'atmosphère terrestre, où il ne représente qu'une molécule sur un million. Il possède 33 isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. connus, mais seuls cinq d'entre eux sont stables, le plus abondant étant le krypton 84 (84Kr), à raison de 57 %.
Origine du krypton
Le krypton est produit, à l'instar du sélénium et du brome, par capture de neutrons lors d'explosions de supernovae à effondrement de cœur (supernovae de type II) ou de fusions d'étoiles à neutrons (kilonovae). Le mécanisme qui intervient ici est appelé processus r, la lettre r signifiant qu'il s'agit d'un processus de capture rapide, nécessitant un flux de neutrons très élevé.

Un peu d'histoire
Le krypton a été découvert par les chimistes britaniques William Ramsay (à qui l'on doit également la découverte de l'hélium, de l'argon, du néon et du xénon !) et Morris William Travers, le 30 mai 1898. Il tire son nom du grec "kryptos" signifiant "caché", tant il est discret.
Propriétés du krypton
A l'instar des autres gaz rares, le krypton est totalement inerte chimiquement. En 1963, N.Barlett parvient
toutefois à le faire réagir avec le difluor et à former du difluorure de krypton (KrF2), mais cela
reste une exception.
Environ trois fois plus dense que l'air, sa température de liquéfaction est de -153°C. Lorsqu'il est soumis à un
courant électrique, il produit une lumière blanc-bleuté, ce qui lui vaut d'être utilisé dans certaines lampes haut
de gamme de photographes.
Production industrielle du krypton
Le krypton est obtenu par distillation fractionnée de l'air liquide. tout simplement. En 2017, ce sont près de 130 000 m3 qui ont ainsi été produits au niveau mondial, principalement par l'Ukraine et la Russie.
Quelques exemples d'utilisation du krypton
- La principale utilisation du krypton est l'isolation thermique des doubles (ou triples) vitrages, puisqu'il s'avère être dans ce domaine trois fois plus efficace que l'argon (et six fois plus efficace que l'air).
- Dans les lampes halogènes, le krypton empêche l'évaporation du filament de tungstène de façon plus efficace que l'argon ou l'azote. Ce type de lampe est toutefois appelé à disparaître, leur production et leur commercialisation étant désormais interdite dans l'Union européenne.
- Le krypton est employé dans certains lasers utilisés en chirurgie ou dans la recherche sur la fusion nucléaire.
- De 1960 à 1983, le krypton a servit à établir le mètre, ce dernier étant alors défini comme
correspondant à 1 650 763,73 fois la longueur d'onde de la raie spectrale orange émise par l'isotope
86Kr dans le vide.
Astronomie pour les myopes -
Mentions légales