Le fluor (Z = 9)
Premier élément du groupe des halogènes (du grec "hals" signifiant "sels"), le fluor possède dix-huit isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons., mais un seul d'entre eux est stable, le fluor 19 (19F), qui est de ce fait le seul à être présent sur Terre. On en trouve dans divers minéraux (fluorite !, cryolite, fluorapatite...), ainsi que dans le charbon et l'argile.
Origine du fluor
Le fluor 19 est essentiellement produit dans le coeur des étoiles plus massives que le Soleil, au cours
d'une variante du cycle CNO. Pour rappel, le cycle CNO consiste en une suite de réactions faisant
intervenir le carbone 12 (qui joue le rôle de catalyseur), et qui permet de convertir l'hydrogène en hélium
de façon plus efficace que la
chaine PPLa chaine proton-proton est l'une des principales séries de réactions
nucléaires convertissant l'hydrogène en hélium au coeur des étoiles de masse modeste appartenant à la séquence
principale (le Soleil en fait lui-même partie)
.
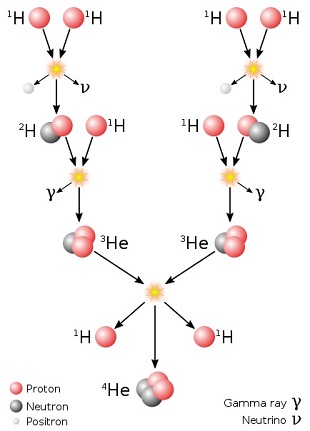 (chaîne proton-proton). Regardons cela de plus près.
(chaîne proton-proton). Regardons cela de plus près.
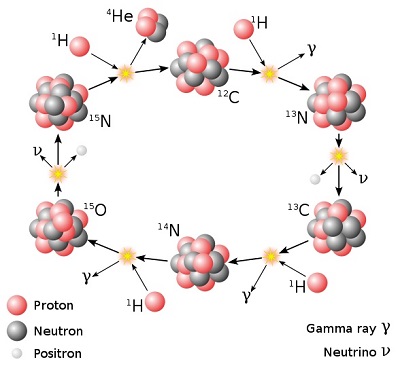
A la fin du cycle CNO "standard", on voit (en haut à gauche) que de l'azote 15 (15N) réagit avec un proton (1H) pour donner un noyau d'hélium et un noyau de carbone 12. Enfin, c'est ce qui se produit la plupart du temps. Mais il arrive que l'azote 15 forme, avec ce proton, un noyau d'oxygène 16, qui réagit à son tour avec un proton pour donner un noyau de fluor 17 (instable), qui se désintègre en donnant de l'oxygène 17 qui, réagissant à son tour avec un proton, donne (parfois) du fluor 18 (instable), qui se désintègre en donnant de l'oxygène 18 qui, enfin, donne (en réagissant avec un proton) du fluor 19 selon le mécanisme suivant :
18O + 1H ---> 19F + rayons gammas
Oufff... Tout cela pour dire qu'au coeur des étoiles, les choses sont loin d'être simples. D'autant moins simples que ce mécanisme produit en réalité très peu de fluor, pas assez en tout cas pour expliquer l'abondance de cet élément. Il faut donc trouver autre chose. L'une des pistes envisagées est celle de la supernova, cet événement cataclysmique qui se produit quand une étoile massive (au moins huit masses solaires) arrive en fin de vie. L'étoile libère alors une quantité colossale de neutrinos, suffisamment énergétiques pour provoquer des réactions de spallation, au cours desquelles de gros noyaux sont brisés pour en donner de plus petits. Eh bien lorsque ces neutrinos arrachent un proton à un noyau de néon, on obtient... du fluor.
Un peu d'histoire
Le fluor tire son nom du latin "fluor" signifiant "écoulement". Son existence est attestée dès 1530 par le saxon Georgius Agricola (1494-1555), père de la minéralogie et de la métallurgie (à laquelle il consacre l'ouvrage "De Re Metallica"). Observant les points communs entre les acides muriatique (chlorhydrique) et fluorique (fluorhydrique), André Marie Ampère (1775-1836) suggère en 1810 l'existence d'un nouvel élément auquel il donne le nom de fluor. En raison de sa très grande réactivité (qui le rend presque impossible à isoler), la quête de cet élément insaisissable occupera les chimistes pendant une bonne partie du XIXè siècle. Il faut attendre l'année 1886 pour qu'enfin le pharmacien français Henri Moissan (1852-1907) parvienne à l'isoler par électrolyse du fluorure de potassium (KF). Cette découverte lui vaut le prix Nobel de chimie en 1906.

Crédit : Generalstabens litografiska anstalt
Propriétés du fluor
Le fluor est le plus réactif de tous les éléments chimiques, et il n'y a que l'hélium et le néon avec
lesquels il ne donne aucun composé connu à ce jour. Le corps simple du fluor est, dans les
CNTPLes CNTP ou conditions normales de température et de pression sont
considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire,
définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013
bars).,
un gaz très toxique et irritant de couleur jaune pâle, le difluor (F2). Il s'agit d'un
oxydant très puissant, capable de réagir avec le sable et le verre, ce qui oblige à le conserver dans des
récipients en téflon. Il réagit de façon explosive avec le dihydrogène, et bien qu'il ne soit pas inflammable,
il peut produire une flamme lorsqu'il entre en contact avec d'autres substances (par exemple avec le soufre).
Sa température d'ébullition est de -188°C, et il se solidifie à -220°C.
Production industrielle du fluor
Chaque année, ce sont près de 20 000 tonnes de difluor (F2) qui sont produites au niveau mondial. Celui-ci est obtenu à partir de fluorine (ou spath fluor), espèce minérale composée de fluorure de calcium (CaF2), première source naturelle de fluor, dont les principaux gisements sont situés en Afrique du Sud, en Chine et au Mexique (où se trouve la mine la plus importante, celle de Las Cuevas, près de San Luis de Potosi). Les réserves mondiales de fluorine sont estimées à plus de 230 millions de tonnes.

Si la fluorine contient plus de 97 % de fluorure de calcium (on dit alors qu'elle est de "qualité acide"), on l'attaque à l'aide d'acide sulfurique pur à 100 %, ce qui permet de produire du fluorure d'hydrogène (HF) :
CaF2 + H2SO4 ---> CaSO4 + 2 HF
Celui-ci, après ajout d'un peu de fluorure de potassium (KF), est ensuite décomposé par électrolyse. On obtient alors du dihydrogène (à la cathode) et du difluor (à l'anode) :
2 HF ---> H2 + F2
Quelques exemples d'utilisation du fluor
Toujours en raison de son extrême réactivité, le fluor n'est jamais utilisé pur. Par contre, ses composés trouvent de nombreuses applications (la petite liste ci-dessous est loin d'être exhaustive).
- Il entre dans la composition du polytétrafluoroéthylène (ou PTFE), commercialisé sous le nom de Téflon, utilisé notamment comme revêtement dans les poêles anti-adhésives.
- Les gaz frigorifiques chlorofluorocarbonés (CFC), plus connus sous le nom de Fréons, contiennent du fluor. Ils ne sont aujourd'hui plus employés dans les systèmes de réfrigération, car ils sont soupçonnés de contribuer à la destruction de la couche d'ozone.

marque Frigidaire.
Par N. C. Wyeth
- Dans le domaine nucléaire, l'hexafluorure d'uranium (UF6) permet de séparer les différents isotopes de l'uranium par diffusion gazeuse et ultracentrifugation, afin de d'enrichir ce dernier en uranium 235 (235U), utilisé comme "combustible" dans les centrales nucléaires.
- L'acide fluorhydrique est utilisé pour attaquer le verre (à des fins de polissage ou de gravure), pour le raffinage du pétrole, ou encore pour décaper les métaux. Il est également employé pour convertir l'uranium en hexafluorure d'uranium, et permet la synthèse du Téflon et du Fréon.
- Des fluorures sont ajoutés dans le sel de table et dans le dentifrice, afin de protéger contre les caries dentaires.

- La cryolite, minerai de formule Na3AlF6, intervient dans la production de l'aluminium. Ajoutée à la poudre d'alumine provenant de la bauxite, elle permet d'en abaisser la température de fusion (vers 960°C, au lieu de 2040°C). Le mélange ainsi obtenu est ensuite soumis à un courant électrique très intense (environ 400 000 ampères !), ce qui permet d'en extraire l'aluminium par électrolyse.

du Groënland
- Le fluor est utilisé dans certaines armes chimiques, comme le gaz sarin (qui fut employé dans l'attentat du métro de Tokyo, perpétré en 1995 par la secte Aum Shinrikyo).
- Le chlorhydrate de fluoxétine est un psychotrope utilisé comme antidépresseur dans certains médicaments (comme le Prozac).
- Le fluor est à l'origine de la substance la plus inflammable que l'on connaisse, le trifluorure de chlore
(ou ClF3), liquide jaune verdâtre (du moins à température ambiante) synthétisé en 1931 par les chimistes
allemands Otto Ruff et Herbert Krug. Extrêmement dangereux, il s'enflamme spontanément au contact de la plupart des
matières organiques (donc de la peau), il réagit violemment avec l'eau, avec le verre, et attaque même le béton.
Cette facheuse tendance à s'enflammer avec tout et n'importe quoi fait qu'on ne lui a trouvé que très peu d'usages
(il intervient dans la synthèse du pentafluorure de chlore, parfois employé pour propulser certains missiles).
Le chlore (Z = 17)
Le chlore fait partie du 17ème groupe (17ème colonne) de la classification périodique, appelé groupe des halogènes (du grec "hals" signifiant "sels"), auquel appartiennent également le fluor, le brome, l'iode et l'astate. Il possède 24 isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. connus, mais seuls deux d'entre eux sont stables: le chlore 35 (35Cl), pour 75,8 %, et le chlore 37 (37Cl), pour 24,2 %. Il s'agit de l'halogène le plus commun sur Terre, puisqu'en terme de masse il arrive en troisième position dans les océans (après l'oxygène et l'hydrogène), avec une moyenne de 19 g/L.
Origine du chlore
Le chlore est synthétisé par de vieilles massives (au moins huit masses solaires) arrivées au stade de la fusion de l'oxygène, lorsque la température centrale est proche de deux milliards de kelvins et la densité d'environ 10 tonnes / cm3. Une foule de particules alpha, de protons et de neutrons sont alors libérés (de gros noyaux sont brisés par les photons gammas très énergétiques), qui participent ensuite à la synthèse d'éléments tels que le chlore, l'argon, le potassium, le calcium... Du chlore sera également produit lors de l'explosion de l'étoile (supernova).
Un peu d'histoire
Le dichlore (Cl2) a été produit pour la première fois en 1774, par le chimiste suédois Carl Wilhelm Scheele (1742-1786), mais ce dernier pensait qu'il s'agissait d'un corps composé contenant de l'oxygène. Il faut attendre l'année 1810 pour que le l'anglais Humphry Davy (1778-1829) comprenne qu'il s'agit en réalité d'un nouvel élément, qu'il appelle chlore, à partir du grec "khlôros" signifiant "vert".

Par Ida Falander (1842—1927)
Propriétés du chlore
A l'état de corps simple, le chlore se présente sous la forme d'un gaz de couleur jaune verdâtre (ci-dessous à gauche), constitué de molécules ayant pour formule Cl2 (dichlore). Il s'agit d'un gaz très toxique et irritant pour les voies respiratoires, environ 2,5 fois plus dense que l'air dans les CNTPLes CNTP ou conditions normales de température et de pression sont considérées de façon arbitraire comme étant les conditions d'expérimentation et de mesure en laboratoire, définies par une température de 0°C (273,15 K) et une pression de 1 atmosphère (soit 101 325 Pa ou 1,013 bars).. Toujours dans les conditions normales, il passe à l'état liquide (ci-dessous à droite) en dessous de -34°C.


Dans la nature, le chlore forme principalement des sels avec d'autres éléments (chlorure de sodium, chlorure de potassium...). Bien qu'il soit moins réactif que le fluor, il n'en demeure pas moins susceptible de former facilement de nombreux composés. Il présente notamment une très grande affinité pour l'hydrogène, avec lequel il réagit vigoureusement, un mélange de dichlore et de dihydrogène pouvant même s'avérer explosif lorsqu'il est exposé à la lumière. Au cours de cette réaction, il se forme du chlorure d'hydrogène (HCl), gaz très soluble dans l'eau, à partir duquel on obtient de l'acide chlorhydrique (qui n'est autre qu'une solution aqueuse de chlorure d'hydrogène). Le dichlore est également considéré comme un comburant, en particulier avec les hydrocarbures, dont il entretient la combustion.
Le chlore est indispensable au bon fonctionnement de notre organisme : il intervient dans les mécanismes d'hydratation (en répartissant l'eau dans notre corps), et il participe au maintien de l'équilibre acido-basique ainsi qu'à la fabrication des sucs gastriques indispensables à la digestion. Et bien d'autres choses encore, mais je ne suis pas médecin...
Production industrielle du chlore
Le chlore est, majoritairement, obtenu par électrolyse de solutions aqueuses de chlorure de sodium : cela
permet, moyennant certaines précautions, de récupérer du dichlore à l'anode. Et à la cathode me direz-vous ?
Et bien on récupère du sodium, qui est ensuite utilisé pour fabriquer de la soude. C'est la raison pour
laquelle la production de ces deux substances est généralement liée : un fabriquant de soude produit également
du chlore, et réciproquement. C'est ainsi qu'en France, l'usine électrochimique de Pomblière (en Savoie),
spécialisée dans la production du sodium, fournit également près de 42 000 tonnes de chlore par an.
En 2019, ce sont plus de 80 millions de tonnes de dichlore qui ont été produites au niveau mondial, la Chine
arrivant largement en tête (avec près de 35 millions de tonnes), devant les Etats-Unis et le Canada.
Quelques exemples d'utilisation du chlore
- Lors de la Première Guerre mondiale, les gaz de combat ont été employés dans une large mesure. L'un des plus connus, l'ypérite, du nom de la ville d'Ypres (Belgique) où il fut utilisé pour la première fois (septembre 1917), répandait une odeur rappelant celle de l'ail ou de la moutarde, d'où son surnom de gaz moutarde. Sa formule : C4H8Cl2S. Du carbone, de l'hydrogène, du chlore, du soufre, et c'est tout. Les effets sur ses malheureuses victimes ? Des cloques très douloureuses sur la peau, des brûlures parfois sévères, les yeux et les paupières irrités au point de rendre momentanément aveugle, des oedèmes pulmonaires souvent mortels, des prédisposition aux cancers, et j'en passe.

L'inventeur de cette merveille ? Le chimiste allemand Fritz Haber (1868-1934), plus connu pour avoir mis au point un procédé de synthèse de l'ammoniac (NH3), grâce auquel on put produire des engrais en grandes quantités (il reçut pour cela le prix Nobel de chimie en 1918). Alors, bienfaiteur de l'humanité ou criminel de guerre ? A vous de juger...

masques à gaz - Ypres, 1917
Crédit : Frank Hurley
- Le chlore, connu pour ses vertus bactéricides, est employé sous forme de dichlore (Cl2) ou de dioxyde de chlore (ClO2) pour désinfecter et potabiliser l'eau, car il s'avère efficace même lorsque celle-ci doit voyager sur de longues distances dans le réseau de distribution.
- Le dichloroisocyanurate de sodium (excusez du peu) est utilisé pour désinfecter l'eau des piscines. Dans l'eau, il se décompose en acide hypochloreux (HClO), puissant antibactérien, qui se décompose lui-même partiellement en ions hypochlorites (ClO-), ces mêmes ions que l'on trouve dans l'eau de javel.

- Le dioxyde de chlore (ClO2), associé au peroxyde d'hydrogène (H2O2), est également utilisé comme agent de blanchiment de la pâte à papier (qui à la base a une teinte jaunâtre).
- Le polychlorure de vinyle, plus connu sous le nom de PVC, résulte de la polymérisation du chlorure de vinyle (CH2=CHCl). Il est fabriqué à partir de pétrole et de chlorure de sodium (NaCl) extrait de l'eau de mer. Le PVC est utilisé pour fabriqué des tuyaux de canalisation, des revêtements muraux, des encadrements de portes ou de fenêtres, etc...
- Le sel de table, ou chlorure de sodium, est utilisé pour fabriquer la soude caustique, l'acide chlorhydrique, et le dichlore.

- Le chlore est également employé dans la fabrication d'antisceptiques, d'insecticides, de peintures...
- Les perchlorates, ions de formule ClO4-, sont de puissants oxydants capable de former facilement des mélanges déflagrants, raison pour laquelle on les utilise souvent en pyrotechnie. C'est ainsi que le perchlorate d'ammonium est employé dans les munitions d'armes à feu, dans les feux d'artifices, comme propulseur de missiles ou encore dans les boosters du lanceur Ariane 5.
- L'eau de Javel est une solution aqueuse de chlorure et d'hypochlorite de sodium, utilisée comme agent désinfectant et décolorant. Son nom vient de l'ancien village de Javel (qui fait aujourd'hui partie du quinzième arrondissement de Paris), où elle a vu le jour en 1784, dans une manufacture de produits chimiques située près du "Moulin de Javel". Son invention est attribuée au chimiste français Claude-Louis Berthollet (1748-1822), qui étudiait alors les propriétés décolorantes du chlore.
- Etc... (il est temps de chlore le sujet).
Le brome (Z = 35)
Le brome fait partie du 17ème groupe (17ème colonne) de la classification périodique, appelé groupe des halogènes (du grec "hals" signifiant "sels"), auquel appartiennent également le fluor, le chlore, l'iode et l'astate. Il possède 32 isotopesOn appelle isotopes des atomes ayant le même nombre de protons, mais qui différent par leur nombre de neutrons. connus, mais seuls deux d'entre eux sont stables: le brome 79 (79Br), pour 50,7 %, et le brome 81 (81Br), pour 49,3%. Peu abondant dans la croûte terrestre (il n'arrive qu'en 62ème position), il l'est un peu plus (tout est relatif) dans les océans, à raison de 67 mg/L (soit presque 300 fois moins que le chlore !).
Origine du brome
Le brome est produit, à l'instar du sélénium et du krypton, par capture de neutrons lors d'explosions de supernovae à effondrement de cœur (supernovae de type II) ou de fusions d'étoiles à neutrons (kilonovae). Le mécanisme qui intervient ici est appelé processus r, la lettre r signifiant qu'il s'agit d'un processus de capture rapide, nécessitant un flux de neutrons très élevé.
Un peu d'histoire
Le brome a été "découvert" en 1826 par le chimiste français Antoine-Jérôme Balard, qui réussit à l'isoler en faisant réagir du dichlore sur des cendres de varech. Appelé dans un premier temps "muride" (du latin muria signifiant saumure), il est par la suite renommé "brome" (du grec "brômos" qui signifie "puanteur") en raison de son odeur désagréable.

Bon, soyons honnête, le chimiste allemand Carl Jacob Löwig l'avait déjà découvert en 1825, dans un échantillon d’eau minérale de Bad Kreuznach (ville allemande), mais Balard ayant publié sa découverte le premier, l'histoire a retenu son nom.
Petite parenthèse : la pourpre de Tyr, également appelée pourpre impériale est, comme son nom l'indique, un pigment de couleur rouge violacée, utilisé depuis l'Antiquité (il en est d'ailleurs fait mention dans la Bible). Inventé par les phéniciens, il était notamment produit dans la ville de Tyr, à partir du murex épineux, petit coquillage appartenant à la famille des gastéropodes. En raison de son coût très élevé, il était bien entendu réservé à une élite, et fut notamment associé au pouvoir impérial chez les Romains. Mais pourquoi en parler ici ? Tout simplement parce que la molécule responsable de sa couleur - le 6,6'-dibromoindigo - est, comme son nom l'indique, un composé du brome.
Propriétés du brome
Dans les conditions normales, le brome (il s'agit en réalité de dibrome, de formule Br2) se
présente sous forme d'un liquide relativement dense (environ 3 g/cm3), toxique et très volatil (il dégage
une vapeur rousse, que l'on peut voir sur l'image ci-dessous).
Il gèle à -7,2°C, et bout à 58,8°C, ce qui fait de lui le seul
corps simpleUn corps simple est une substance constituée d'un seul type d'élément chimique,
par opposition aux corps composés, constitués d'au moins deux éléments différents.
(avec le mercure) à être liquide à température ambiante.

Crédit : Jurii
Il réagit vivement avec les métaux, en donnant des sels métalliques (bromure de fer, bromure d'argent...), ainsi qu'avec de nombreux composés organiques. Relativement soluble dans l'eau, il forme avec cette dernière de l'eau de brome, légèrement acide.
Le brome peut provoquer des lésions cutanées, ainsi qu'une forte irritation des voies respiratoires. Sous forme d'ion bromure il s'avère peu toxique, mais une exposition à des quantités élevées peut être à l'origine d'une intoxication appelée bromisme, qui se traduit par des perturbations plus ou moins importantes des fonctions neurologiques.
Production industrielle du brome
Le dibrome est essentiellement extrait des eaux de la Mer Morte, ainsi que de saumures souterraines dans l'état de l'Arkansas, aux États-Unis. Les ions bromures contenus dans ces saumures sont transformés en dibrome grâce au dichlore, selon la réaction suivante :
2 Br– + Cl2 ---> 2 Cl– + Br2
Israël, principal producteur mondial, en a fourni 180 000 tonnes en 2022, suivi de l'Arkansas (130 000 tonnes) et de la Jordanie (110 000 tonnes).
Quelques exemples d'utilisation du brome
- Les retardateurs de flammes bromés (ou RFB) sont ajoutés à divers produits afin de les rendre moins inflammables. On les trouve notamment dans les plastiques, les textiles (par exemple dans certains pyjamas pour enfants), les mousses (polyuréthane), les équipements électroniques... Ce secteur consomme à lui seul environ 38% de la production annuelle de brome, ce qui n'est pas sans poser problème car il existe des doutes quant à l'innocuité des RFB, qui peuvent se retrouver dans l'environnement et contaminer la chaîne alimentaire.
- Depuis 1936, le brome est utilisé pour désinfecter l'eau, en particulier pour traiter l'eau des piscines et des spas, à la place du chlore. Il est à la fois bactéricide, algicide et fongicide, et présente sur le chlore l'avantage d'être inodore, de ne pas irriter la peau et les yeux, et de ne pas réagir aux UV (contrairement au chlore).
- Le bromure d'argent, en raison de sa grande sensibilité à la lumière, a longtemps été utilisé dans la photographie argentique noir et blanc, et ce depuis les années 1840.
- En raison de ses propriétes sédatives et antispasmodiques, le bromure de potassium (KBr) est utilisé comme antiépileptique dans certains pays (notamment en Allemagne).

Mythe ou réalité, le bromure de potassium aurait été employé autrefois dans l'armée (notamment au Vietnam), afin d'inhiber le désir sexuel des soldats.
- En laboratoire, le bleu de bromothymol est souvent utilisé comme indicateur de pH : il prend la couleur bleue si le pH de la solution est supérieur à 7,6 (solution basique), jaune s'il est inférieur à 6 (solution acide), et fushia si le pH est proche de 0 (solution très acide).

en fonction du pH de la solution
Crédit : Sébastien Bruneau
Voilà pour l'essentiel...
Astronomie pour les myopes -
Mentions légales